Hvad er de forskellige molekyler, der udgør luft i rummet, har i gennemsnit det samme kinetiske?
Den kinetiske teori om gasser og temperatur
* kinetisk energi er bevægelsesenergien. Jo hurtigere et molekyle bevæger sig, jo mere kinetisk energi har den.
* Temperatur er et mål for den gennemsnitlige kinetiske energi af molekylerne i et stof.
* den kinetiske teori om gasser siger, at den gennemsnitlige kinetiske energi af gasmolekyler er direkte proportional med den absolutte temperatur (målt i Kelvin).
forskellige molekyler i luft
Luft er en blanding af gasser, primært nitrogen (N2), ilt (O2) og mindre mængder argon (AR), kuldioxid (CO2) og andre sporingsgasser. Mens disse molekyler har forskellige masser, ved en given temperatur, vil de have den samme gennemsnitlige kinetiske energi.
Hvorfor den samme gennemsnitlige kinetiske energi?
* Kollisioner: Gasmolekyler kolliderer konstant med hinanden og væggene i deres beholder. Disse kollisioner overfører energi.
* ligevægt: Over tid fører kollisioner til en tilstand af termisk ligevægt. Dette betyder, at energien fordeles jævnt mellem alle molekyler, uanset deres masse.
* temperatur som en foranstaltning: Temperatur er afspejlingen af denne ligevægt. Når temperaturen er den samme, er den gennemsnitlige kinetiske energi den samme.
Vigtig note: Mens den gennemsnitlige kinetiske energi er den samme, vil molekylernes individuelle hastigheder være forskellige. Lysere molekyler (som nitrogen) vil i gennemsnit bevæge sig hurtigere end tungere molekyler (som kuldioxid) ved den samme temperatur.
Fortæl mig, hvis du har flere spørgsmål!
 Varme artikler
Varme artikler
-
 Lysemitterende elektrokemiske celler til genanvendelig belysningKredit:Technical University München En lavpris og let at fremstille lysteknologi kan fremstilles med lys-emitterende elektrokemiske celler. Sådanne celler er tyndfilm elektroniske og ioniske enhede
Lysemitterende elektrokemiske celler til genanvendelig belysningKredit:Technical University München En lavpris og let at fremstille lysteknologi kan fremstilles med lys-emitterende elektrokemiske celler. Sådanne celler er tyndfilm elektroniske og ioniske enhede -
 Eksponering for ultraviolet lys øger syntetisk melanins beskyttende evneKredit:University of Akron Melanins høje brydningsindeks (RI) og bredbåndsabsorptionsevne bidrager til pigmentets evne til at beskytte mod ultraviolet stråling (UV). Disse optiske egenskaber bidra
Eksponering for ultraviolet lys øger syntetisk melanins beskyttende evneKredit:University of Akron Melanins høje brydningsindeks (RI) og bredbåndsabsorptionsevne bidrager til pigmentets evne til at beskytte mod ultraviolet stråling (UV). Disse optiske egenskaber bidra -
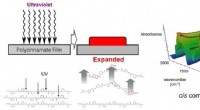 Fotoudvidelse:Biobaserede polyestere hård filmDen UV-inducerede deformation af polycinnamatet blev analyseret ved tidsopløst IR-spektroskopi, og det blev bekræftet, at fotoudvidelse fandt sted baseret på trans-til-cis-isomerisering af cinnamatenh
Fotoudvidelse:Biobaserede polyestere hård filmDen UV-inducerede deformation af polycinnamatet blev analyseret ved tidsopløst IR-spektroskopi, og det blev bekræftet, at fotoudvidelse fandt sted baseret på trans-til-cis-isomerisering af cinnamatenh -
 Selvrensende beton kan få bygninger til at se nye udSelvrensende beton kunne holde bygninger til at se ud som nye ved at afvise alle slags væsker, såsom kaffe og mælk. Kredit:American Chemical Society Byggematerialer, der renser sig selv, kan spare
Selvrensende beton kan få bygninger til at se nye udSelvrensende beton kunne holde bygninger til at se ud som nye ved at afvise alle slags væsker, såsom kaffe og mælk. Kredit:American Chemical Society Byggematerialer, der renser sig selv, kan spare
- Rumdatarelæsystem viser dets hastighed
- Hvordan stiger solen altid i øst og går mod vest?
- Nogle lemurer er ensomme, andre kræver forbindelse
- Hvad er den gennemsnitlige sammensætning af klipper, der omfatter en stor sammensat kegle eller str…
- Hvad er ferruginious jord?
- Hvordan påvirker brændstof miljøet?


