Hvad bestemmer form og volumen af en gas inde i beholderen?
1. Containeren selv:
* form: En gas tager form af sin beholder. Hvis beholderen er en rektangulær kasse, fylder gassen hele kassen. Hvis det er en kugle, vil gassen tage en sfærisk form.
* bind: Mængden af beholderen begrænser direkte volumen, gassen kan optage.
2. Egenskaber ved gassen:
* Temperatur: Højere temperaturer betyder, at gasmolekylerne har mere kinetisk energi, hvilket får dem til at bevæge sig hurtigere og kollidere med containervæggene oftere. Dette øgede tryk kan få gassen til at udvide til et større volumen, hvis beholderen er fleksibel.
* tryk: Det tryk, der udøves af gassen på containervæggene, er også en faktor. Højere tryk betyder, at gasmolekylerne skubber hårdere mod væggene, hvilket kan påvirke det volumen, gassen optager.
* mængde gas: Jo flere gasmolekyler der er i beholderen, jo flere kollisioner med væggene og jo højere tryk, hvilket kan påvirke volumen.
3. Interaktioner mellem gasmolekyler:
* Intermolekylære kræfter: Dette er de attraktive kræfter mellem gasmolekyler. Selvom de generelt er svage i gasser, kan de stadig påvirke gassens opførsel, især ved høje tryk eller lave temperaturer.
Nøglekoncept: Gasser er meget komprimerbare. Dette betyder, at deres volumen kan ændre sig markant som respons på ændringer i tryk, temperatur eller mængden af gas.
Kortfattet:
Formen og volumen af en gas bestemmes af den beholder, den er i, dens temperatur, tryk og mængden af til stede. Opførelsen af en gas styres af gaslovene, der beskriver forholdet mellem disse faktorer.
Sidste artikelHvad kaldes det, når der er en overførsel af varme gennem rummet uden molekyler?
Næste artikelHvordan blev fonograf lavet?
 Varme artikler
Varme artikler
-
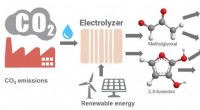 Hvordan man omdanner klimaforandrende kuldioxid til plast og andre produkterDette billede viser, hvordan kuldioxid kan omdannes elektrokemisk til værdifulde polymer- og lægemiddelprækursorer. Kredit:Karin Calvinho/Rutgers University-New Brunswick Rutgers-forskere har udvi
Hvordan man omdanner klimaforandrende kuldioxid til plast og andre produkterDette billede viser, hvordan kuldioxid kan omdannes elektrokemisk til værdifulde polymer- og lægemiddelprækursorer. Kredit:Karin Calvinho/Rutgers University-New Brunswick Rutgers-forskere har udvi -
 Tynde film af en blyfri piezoelektrik matcher endelig ydeevnen af den blybærende standardEt elektronmikroskopibillede af den tynde KNN-film, der viser den kontrollerede dannelse af de krystallinske domæner, der er ansvarlige for den piezoelektriske effekt. Kredit:A*STAR Institute of Mater
Tynde film af en blyfri piezoelektrik matcher endelig ydeevnen af den blybærende standardEt elektronmikroskopibillede af den tynde KNN-film, der viser den kontrollerede dannelse af de krystallinske domæner, der er ansvarlige for den piezoelektriske effekt. Kredit:A*STAR Institute of Mater -
 Uorganiske perovskit absorbere til brug i tyndfilm solcellerVed samtidig fordampning af cæsiumiodid og blyiodid kan der fremstilles tynde lag af CsPbI3 selv ved moderate temperaturer. Et overskud af cæsium fører til stabile perovskitfaser. Kredit:J. Marquez-Pr
Uorganiske perovskit absorbere til brug i tyndfilm solcellerVed samtidig fordampning af cæsiumiodid og blyiodid kan der fremstilles tynde lag af CsPbI3 selv ved moderate temperaturer. Et overskud af cæsium fører til stabile perovskitfaser. Kredit:J. Marquez-Pr -
 Bevæg dig over tunge beskyttelsesbriller, her kommer de ultrahøje brydningsindekslinserKredit:Pohang University of Science &Technology (POSTECH) Et POSTECH-forskerhold har udviklet et gennemsigtigt amorft silicium, der transmitterer synligt lys-hvilket gør det muligt for os at skeln
Bevæg dig over tunge beskyttelsesbriller, her kommer de ultrahøje brydningsindekslinserKredit:Pohang University of Science &Technology (POSTECH) Et POSTECH-forskerhold har udviklet et gennemsigtigt amorft silicium, der transmitterer synligt lys-hvilket gør det muligt for os at skeln


