Hvorfor kan gasser ændre volumen?
* svage intermolekylære kræfter: Gasmolekyler har meget svage attraktive kræfter mellem dem. Dette giver dem mulighed for at bevæge sig frit og uafhængigt, i modsætning til væsker og faste stoffer, hvor molekyler er mere tæt bundet.
* Store intermolekylære afstande: Molekylerne i en gas er langt fra hinanden sammenlignet med væsker og faste stoffer. Dette betyder, at der er en masse tomme mellemrum mellem dem.
* Kompressibilitet: På grund af de store rum mellem molekyler kan gasser let komprimeres. Når der påføres tryk, presses molekylerne tættere sammen, hvilket reducerer volumenet.
* udvidelighed: Omvendt, hvis trykket på en gas reduceres, kan molekylerne bevæge sig længere fra hinanden og øge volumenet.
Her er en analogi: Forestil dig et værelse fuld af mennesker. Hvis folket er pakket tæt, er rummet fuldt, og der er lidt plads til at bevæge sig. Dette er som en komprimeret gas. Forestil dig nu, at folket er spredt med masser af plads mellem dem. Dette er som en gas ved lavt tryk.
Faktorer, der påvirker gasvolumen:
* Temperatur: Højere temperatur betyder, at molekyler bevæger sig hurtigere og kolliderer oftere, skubber mod beholdervæggene og øger volumen.
* tryk: Højere tryk kræfter molekyler tættere sammen, hvilket falder volumen.
* mængde gas: Flere gasmolekyler betyder flere kollisioner og større tryk, hvilket øger volumen, hvis trykket holdes konstant.
Kortfattet: Gasser kan ændre volumen, fordi deres molekyler er svagt tiltrukket af hinanden, har store mellemrum mellem dem og let komprimeres eller udvides på grund af tilstedeværelsen af tomt rum.
Sidste artikelHvad kaldes det, når væske bliver til en gas?
Næste artikelHvorfor flyder et stof over et andet?
 Varme artikler
Varme artikler
-
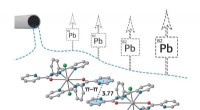 Kemikere foreslår nye reagenser til fjernelse af bly fra spildevandKredit:RUDN University RUDN -universitetets kemikere har sammen med kolleger fra andre lande syntetiseret nye forbindelser, der effektivt binder blyioner og kan bruges til at fjerne det fra spilde
Kemikere foreslår nye reagenser til fjernelse af bly fra spildevandKredit:RUDN University RUDN -universitetets kemikere har sammen med kolleger fra andre lande syntetiseret nye forbindelser, der effektivt binder blyioner og kan bruges til at fjerne det fra spilde -
 Væske har struktur, hvilket kan være nøglen til at forstå metallisk glasBillede fra transmissionselektronmikroskop af metalliske glas nanorods. Kredit:Judy Cha Forskere har fundet ud af, at væske har struktur under visse omstændigheder, og at denne struktur i væsentli
Væske har struktur, hvilket kan være nøglen til at forstå metallisk glasBillede fra transmissionselektronmikroskop af metalliske glas nanorods. Kredit:Judy Cha Forskere har fundet ud af, at væske har struktur under visse omstændigheder, og at denne struktur i væsentli -
 Russiske forskere udvikler et smart sorbent til vandrensningKredit:South Ural State University Forskere fra South Ural State University er engageret i oprettelsen af et multifunktionelt kulstofsorbent. Materialet vil være i stand til at optage både flere
Russiske forskere udvikler et smart sorbent til vandrensningKredit:South Ural State University Forskere fra South Ural State University er engageret i oprettelsen af et multifunktionelt kulstofsorbent. Materialet vil være i stand til at optage både flere -
 Dybt eutektiske opløsningsmidler erstatter forurenende industrielle opløsningsmidlerPh.d. -kandidat Dannie van Osch blander to pulvere, indtil de danner en flydende DES. Kredit:Bart van Overbeeke Mange forurenende opløsningsmidler, der bruges af den kemiske industri, kan erstatte
Dybt eutektiske opløsningsmidler erstatter forurenende industrielle opløsningsmidlerPh.d. -kandidat Dannie van Osch blander to pulvere, indtil de danner en flydende DES. Kredit:Bart van Overbeeke Mange forurenende opløsningsmidler, der bruges af den kemiske industri, kan erstatte


