Hvordan er bevægelserne af gaspartikler relateret til tryk fra gas?
1. Kinetisk molekylær teori:
* Den kinetiske molekylære teori om gasser beskriver opførsel af gaspartikler baseret på deres konstante, tilfældige bevægelse.
* Nøglepostulater inkluderer:
* Gaspartikler er i konstant, tilfældig bevægelse.
* Partiklerne er meget mindre end afstandene mellem dem.
* Kollisioner mellem partikler er perfekt elastiske (intet energitab).
* Der er ingen attraktive eller frastødende kræfter mellem partikler.
2. Kollisioner og pres:
* Gastrykket opstår fra kollisioner af gaspartikler med væggene i deres beholder.
* Hver kollision udøver en lille kraft på væggen.
* hyppigere Kollisionerne, højere trykket.
* mere kraftfuld Kollisionerne, højere trykket.
3. Faktorer, der påvirker partikelbevægelse:
* Temperatur: Højere temperatur betyder hurtigere partikelhastigheder, hvilket fører til hyppigere og kraftfulde kollisioner, og dermed højere tryk.
* bind: Mindre volumen betyder, at partikler kolliderer med væggene oftere, hvilket resulterer i højere tryk.
* Antal partikler: Flere partikler betyder flere kollisioner, hvilket fører til højere tryk.
4. Matematisk forhold (ideel gaslov):
Forholdet mellem tryk, volumen, temperatur og antallet af partikler er indkapslet af ideel gaslov:
* pv =nrt
* P =tryk
* V =volumen
* n =antal mol gas
* R =ideel gaskonstant
* T =temperatur (i Kelvin)
5. Resumé:
* Gastryk er en direkte konsekvens af bevægelsen af gaspartikler.
* Frekvensen og kraften af kollisioner mellem gaspartikler og beholdervæggene bestemmer trykket.
* Temperatur, volumen og antallet af partikler påvirker alle partikelbevægelse og derfor gastryk.
I det væsentlige, jo hurtigere og flere gaspartikler er, og jo mindre pladsen de besætter, jo flere kollisioner vil de have med beholdervæggene, hvilket resulterer i højere gastryk.
 Varme artikler
Varme artikler
-
 Simuleringer viser, hvordan atomer opfører sig inde i selvhelende cementEn illustration, der viser den selvhelbredende cement på et molekylært niveau. Kredit:Environmental Molecular Sciences Laboratory Forskere ved Pacific Northwest National Laboratory (PNNL) har udvi
Simuleringer viser, hvordan atomer opfører sig inde i selvhelende cementEn illustration, der viser den selvhelbredende cement på et molekylært niveau. Kredit:Environmental Molecular Sciences Laboratory Forskere ved Pacific Northwest National Laboratory (PNNL) har udvi -
 Kunne vi genbruge plastikposer til fremtidens stoffer?MIT ingeniører har udviklet selvkølende stoffer fra polyethylen, almindeligvis brugt i plastikposer. De vurderer, at det nye stof kan være mere bæredygtigt end bomuld og andre almindelige tekstiler. K
Kunne vi genbruge plastikposer til fremtidens stoffer?MIT ingeniører har udviklet selvkølende stoffer fra polyethylen, almindeligvis brugt i plastikposer. De vurderer, at det nye stof kan være mere bæredygtigt end bomuld og andre almindelige tekstiler. K -
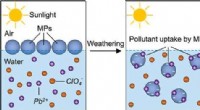 Forskere tager fat på miljøforvitring af mikroplast, optagelse af forurenende stofferGrafisk abstrakt. Kredit:ACS Environmental Au (2022). DOI:10.1021/acsenvironau.2c00036 I et nyt papir fra fakultet og studerende i LSU Chemical Engineering and Chemistry offentliggjort i ACS Enviro
Forskere tager fat på miljøforvitring af mikroplast, optagelse af forurenende stofferGrafisk abstrakt. Kredit:ACS Environmental Au (2022). DOI:10.1021/acsenvironau.2c00036 I et nyt papir fra fakultet og studerende i LSU Chemical Engineering and Chemistry offentliggjort i ACS Enviro -
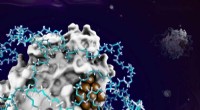 Hybride enzymkatalysatorer syntetiseret ved en de novo tilgang til udvidelse af biokatalyseKredit:Chinese Journal of Catalysis De to store udfordringer i industriel enzymatisk katalyse er det begrænsede antal kemiske reaktionstyper, der katalyseres af enzymer og ustabilitet af enzymer u
Hybride enzymkatalysatorer syntetiseret ved en de novo tilgang til udvidelse af biokatalyseKredit:Chinese Journal of Catalysis De to store udfordringer i industriel enzymatisk katalyse er det begrænsede antal kemiske reaktionstyper, der katalyseres af enzymer og ustabilitet af enzymer u


