Hvad er den lille masseenhed, der bruges til at mærke vægtatomer?
Her er hvorfor det er vigtigt:
* atomer er utroligt små: Deres masser er for små til at udtrykke i gram eller kg.
* Relativ sammenligning: AMU giver os mulighed for let at sammenligne masserne af forskellige atomer. En AMU er defineret som 1/12. massen af et carbon-12-atom.
* praktisk skala: De fleste atomer har atommasser tæt på hele tal, hvilket gør det nemt at arbejde med.
For eksempel har et hydrogenatom en atommasse på cirka 1 amu, mens et iltatom har en atommasse på cirka 16 amu.
Sidste artikelHvad er nogle ikke -polære væsker?
Næste artikelHvad er korrolios princip?
 Varme artikler
Varme artikler
-
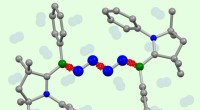 Inert nitrogen tvunget til at reagere med sig selvFor første gang, to molekyler af atmosfærisk nitrogen (blå, midten) er koblet direkte til hinanden i forskning af kemikere fra Würzburg og Frankfurt. Kredit:Dr. Rian Dewhurst / Dr. Marc-André Légaré
Inert nitrogen tvunget til at reagere med sig selvFor første gang, to molekyler af atmosfærisk nitrogen (blå, midten) er koblet direkte til hinanden i forskning af kemikere fra Würzburg og Frankfurt. Kredit:Dr. Rian Dewhurst / Dr. Marc-André Légaré -
 Forstå sprøde revner for at designe stærkere materialerKredit:CC0 Public Domain I et papir udgivet i Naturfysik , Northeastern University Department of Physics Arts and Sciences Distinguished Professor Alain Karma, i samarbejde med hans postdoktoral
Forstå sprøde revner for at designe stærkere materialerKredit:CC0 Public Domain I et papir udgivet i Naturfysik , Northeastern University Department of Physics Arts and Sciences Distinguished Professor Alain Karma, i samarbejde med hans postdoktoral -
 Superfleksible aerogeler er meget effektive absorbenter, termiske isolatorer, og tryksensorerKredit:Wiley Luftig, Luftigere, Aerogel. Indtil nu, skørhed har begrænset den praktiske anvendelse af disse sarte faste stoffer, som næsten udelukkende består af luftfyldte porer. Dette kan nu ænd
Superfleksible aerogeler er meget effektive absorbenter, termiske isolatorer, og tryksensorerKredit:Wiley Luftig, Luftigere, Aerogel. Indtil nu, skørhed har begrænset den praktiske anvendelse af disse sarte faste stoffer, som næsten udelukkende består af luftfyldte porer. Dette kan nu ænd -
 Gennembrud kunne lancere organisk elektronik ud over mobiltelefonskærmeForskere brugte ultraviolet lys til at excitere molekyler i en halvleder, udløser reaktioner, der splittede op og aktiverede et dopingmiddel. Kredit:Jing Wang og Xin Lin En opdagelse af et interna
Gennembrud kunne lancere organisk elektronik ud over mobiltelefonskærmeForskere brugte ultraviolet lys til at excitere molekyler i en halvleder, udløser reaktioner, der splittede op og aktiverede et dopingmiddel. Kredit:Jing Wang og Xin Lin En opdagelse af et interna
- Maskinlæring kan reducere testning, forbedre behandlingen af intensivpatienter
- Silkestilladser og magnetisme til at generere knoglevæv og kunne bruge det i implantater
- Early Earth blev bombarderet af en række asteroider i bystørrelse
- Er det sandt, at videnskabelig bestræbelse er drevet af enten enkel nysgerrighed eller samfundsmæs…
- Hvad forårsager en mekanisk bølge?
- Ny tilgang til bæredygtigt byggeri tager form i Boston


