Udvides alle gasser lige, når de opvarmes?
1. Ideel gaslov:
Den ideelle gaslov (PV =NRT) angiver, at volumenet af en gas er direkte proportional med dens temperatur (i Kelvin) under forudsætning af konstant tryk og mængden af gas. Dette betyder ideelt, volumenændringen på grund af opvarmning skal være den samme for alle gasser.
2. Ægte gasadfærd:
I virkeligheden afviger gasser fra ideel opførsel, især ved høje tryk og lave temperaturer. Dette er fordi:
* Intermolekylære kræfter: Ægte gasmolekyler tiltrækker hinanden, hvilket kan reducere ekspansionen sammenlignet med ideel opførsel.
* molekylær størrelse: Ægte gasmolekyler har endelig størrelse, hvilket kan påvirke deres evne til at bevæge sig frit og udvide.
3. Specifik varmekapacitet:
Forskellige gasser har forskellige specifikke varmekapaciteter, hvilket betyder, at de kræver forskellige mængder varme for at hæve deres temperatur med et bestemt beløb. Dette kan påvirke ekspansionsbeløbet, fordi flere varmeindgang fører til en større temperaturstigning og dermed større ekspansion.
4. Molekylvægt:
Lysere gasser (f.eks. Hydrogen, helium) har en tendens til at udvide mere end tungere gasser (f.eks. Kuldioxid, ilt) ved den samme temperaturstigning på grund af deres højere kinetiske energi ved den samme temperatur.
Konklusion:
Mens den ideelle gaslov antyder lige ekspansion for alle gasser, kan faktorer som intermolekylære kræfter, molekylstørrelse, specifik varmekapacitet og molekylvægt føre til forskelle i ekspansionsadfærd for forskellige gasser.
Derfor ekspanderer ikke alle gasser lige, når de opvarmes.
Sidste artikelKontrakterer gasser og faste stoffer, når de afkøles?
Næste artikelHvad opdagede Rutherford om atomstruktur?
 Varme artikler
Varme artikler
-
 Tubuli for at stoppe cellevækstDannelse og adskillelse af TOROIDer. Kredit:UNIGE TORC1 er et enzymkompleks, der styrer den normale vækst af celler. Imidlertid, når den er for aktiv, det kan fremme sygdomme som kræft. En undersø
Tubuli for at stoppe cellevækstDannelse og adskillelse af TOROIDer. Kredit:UNIGE TORC1 er et enzymkompleks, der styrer den normale vækst af celler. Imidlertid, når den er for aktiv, det kan fremme sygdomme som kræft. En undersø -
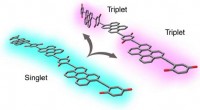 To-til-en energi fra fotoner, nu bedre end nogensindeVed at vride, når man er ophidset, nogle lange kæder af organiske molekyler kan isolere triplet excitoner i modsatte ender af molekylet. Kredit:National Renewable Energy Laboratory Ved vridning og
To-til-en energi fra fotoner, nu bedre end nogensindeVed at vride, når man er ophidset, nogle lange kæder af organiske molekyler kan isolere triplet excitoner i modsatte ender af molekylet. Kredit:National Renewable Energy Laboratory Ved vridning og -
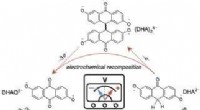 Forskning forlænger levetiden for molekyler i organiske flow-batterier til praktiske værdierFlowbatteriets cyklus. Når molekylet nedbrydes under regelmæssig cykling, kan det genoplives ved, at det skaber en spændingsimpuls, der nulstiller de nedbrydende molekyler tilbage til deres oprindelig
Forskning forlænger levetiden for molekyler i organiske flow-batterier til praktiske værdierFlowbatteriets cyklus. Når molekylet nedbrydes under regelmæssig cykling, kan det genoplives ved, at det skaber en spændingsimpuls, der nulstiller de nedbrydende molekyler tilbage til deres oprindelig -
 En metode til at screene ukendte molekyler af koralrev for deres terapeutiske potentialeKoralrev . Kredit:San Diego State University Koralrev rummer en utrolig mangfoldighed af liv, både havdyr, vi kan se, og mikrobielt liv, som vi ikke kan. Disse organismer genererer et enormt antal
En metode til at screene ukendte molekyler af koralrev for deres terapeutiske potentialeKoralrev . Kredit:San Diego State University Koralrev rummer en utrolig mangfoldighed af liv, både havdyr, vi kan se, og mikrobielt liv, som vi ikke kan. Disse organismer genererer et enormt antal
- Hvad er brugen af kobolt?
- Hvad vil der ske med hastigheden på et rumskib, hvis det slukker for sine motorer i rummet?
- Fremskridt kvantenetværk:Undersøgelse opnår største fotonemissionsforbedring for enkelt T-center…
- Kan kold energi overføres til et objekt?
- Hvad er den mest almindelige klippe, der udvindede ved hjælp af et stenbrud?
- Hvad er to måder, teknologi hjælper videnskabsmand på?


