Væsker har normalt højere volumen koefficienter for ekspansion end faste stoffer gør?
Her er hvorfor:
* Intermolekylære kræfter: Væsker har svagere intermolekylære kræfter end faste stoffer. Dette betyder, at molekylerne i en væske er mindre tæt bundet og har mere frihed til at bevæge sig rundt.
* afstand: Molekylerne i en væske er længere fra hinanden end dem i et fast stof. Denne øgede afstand giver mulighed for mere udvidelse, når temperaturen øges.
i enklere termer: Forestil dig en kasse fyldt med kugler (der repræsenterer molekyler). I et solidt er klyngerne tæt pakket. I en væske har de mere plads til at bevæge sig rundt. Når du opvarmer kassen, spreder kllingerne i væsken sig mere end marmoren i det faste stof, hvilket fører til en større volumenændring (ekspansion).
Eksempel: Vand udvides, når det fryser, fordi molekylerne arrangerer sig i en mindre kompakt struktur i is. Dette er et ekstremt eksempel, men det illustrerer begrebet, hvordan væsker kan have større volumenudvidelse sammenlignet med faste stoffer.
 Varme artikler
Varme artikler
-
 Væske-væske-overgange krystalliserer nye ideer til molekylære væskerKredit:CC0 Public Domain Krystallisation beskriver dannelsen af ordnede strukturer fra de uordnede bestanddele af en væske. Selvom den grundlæggende teori om krystaldannelse er blevet bredt unde
Væske-væske-overgange krystalliserer nye ideer til molekylære væskerKredit:CC0 Public Domain Krystallisation beskriver dannelsen af ordnede strukturer fra de uordnede bestanddele af en væske. Selvom den grundlæggende teori om krystaldannelse er blevet bredt unde -
 Video:Hvad gør tardigrader til så store overlevendeKredit:The American Chemical Society Tardigrader er bittesmå dyr, der kan leve i vanddråber stort set overalt. Når disse vanddråber tørrer ud, tardigrader gennemgår en forbløffende transformation
Video:Hvad gør tardigrader til så store overlevendeKredit:The American Chemical Society Tardigrader er bittesmå dyr, der kan leve i vanddråber stort set overalt. Når disse vanddråber tørrer ud, tardigrader gennemgår en forbløffende transformation -
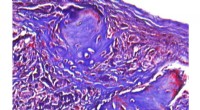 Nye hydrogeler viser lovende behandling af knogledefekterDer er vist et mikroskopisk billede af regenereret knogle i en kraniedefekt hos en mus. Kredit:University of California, Los Angeles Bioingeniører og tandlæger fra UCLA School of Dentistry har udv
Nye hydrogeler viser lovende behandling af knogledefekterDer er vist et mikroskopisk billede af regenereret knogle i en kraniedefekt hos en mus. Kredit:University of California, Los Angeles Bioingeniører og tandlæger fra UCLA School of Dentistry har udv -
 NIST går med det (langsomme) flow:Ny teknik kan forbedre bioteknologien, præcisionsmedicinForskere ved National Institute of Standards and Technology (NIST) har udviklet et optisk system, der nøjagtigt måler strømmen af ekstraordinært små mængder væske - så små som 10 milliardtedele lite
NIST går med det (langsomme) flow:Ny teknik kan forbedre bioteknologien, præcisionsmedicinForskere ved National Institute of Standards and Technology (NIST) har udviklet et optisk system, der nøjagtigt måler strømmen af ekstraordinært små mængder væske - så små som 10 milliardtedele lite
- Sådan sporer prognosemænd orkanen Dorian
- Unge giver udtryk for bekymring for at forbedre katastrofeberedskabspolitikken
- Instagram-medstiftere trækker sig fra sociale medier
- En klippe, der er afbalanceret på en afsats, har hvilken slags energi?
- Hvad er et ikke-eksempel på fortyndet opløsning?
- Hvordan man beskytter biokatalysatorer mod ilt


