Hvad er de principper, der er involveret i krystallisation?
1. Overmætning:
* drivkraften: Krystallisation opstår, når en opløsning bliver overmættet, hvilket betyder, at den indeholder mere opløst opløst stof, end den normalt kan indeholde ved en given temperatur og tryk. Denne tilstand er ustabil, og det overskydende opløsningsmiddel søger at komme ud af opløsningen og danne en solid krystalfase.
* Oprettelse af overmætning: Dette kan opnås på flere måder:
* afkøling af en varm løsning: Når temperaturen falder, falder opløseligheden af de fleste faste stoffer, hvilket fører til overmætning.
* Fordampning: Fjernelse af opløsningsmiddel fra en opløsning øger koncentrationen af opløst stoffet og driver det mod overmætning.
* Tilføjelse af et andet opløsningsmiddel: Blanding af en opløsning med et opløsningsmiddel, hvor opløsningen er mindre opløseligt, kan forårsage nedbør.
* Kemiske reaktioner: Reaktioner, der producerer et solidt produkt, kan føre til overmættelse.
2. Nucleation:
* det første trin: Nukleation er dannelsen af de første små, stabile krystalkerner i den overmættede opløsning. Disse kerner fungerer som frø til yderligere krystalvækst.
* homogen vs. heterogen nucleation:
* homogen: Nukleation forekommer spontant inden for selve opløsningen. Kræver en høj grad af overmætning.
* heterogen: Nukleation forekommer på overfladen af urenheder eller fremmede partikler i opløsningen. Kræver en lavere grad af overmætning.
* Kontrol af nucleation: Omhyggelig kontrol af overmætning og urenheder er afgørende for at producere krystaller med ønsket størrelse og ensartethed.
3. Krystalvækst:
* Tilføjelse til kernerne: Når kerner er dannet, begynder de at tiltrække opløste molekyler og inkorporere dem i deres krystalgitter.
* Lag-for-lag vækst: Krystallvækst er en lag-for-lag-proces, hvor nye molekyler fastgør sig til den eksisterende krystaloverflade på en bestemt og ordnet måde.
* faktorer, der påvirker vækst:
* Overmætningsniveau: Højere overmætning fører til hurtigere vækst, men kan også føre til mindre perfekte krystaller.
* Temperatur: Temperaturen påvirker diffusionshastigheden og opløseligheden af det opløste stof, der påvirker væksten.
* urenheder: Urenheder kan forstyrre krystalvækst og føre til defekter eller uregelmæssigheder.
4. Crystal Habit:
* Formspørgsmål: Den ydre form eller vane af en krystal bestemmes af arrangementet af atomer eller molekyler inden for dets krystalgitter.
* faktorer, der påvirker vane:
* krystalstruktur: Det iboende arrangement af atomer eller molekyler i krystalgitteret dikterer den overordnede form.
* Vækstbetingelser: Temperatur, overmættelsesniveau og tilstedeværelsen af urenheder kan alle påvirke krystalvanen.
5. Crystal Perfection:
* ikke altid perfekt: Krystaller kan have ufuldkommenheder, kendt som defekter, der kan opstå fra forskellige faktorer som vækstbetingelser, urenheder eller gitterstamme.
* Betydningen af perfektion: Krystal perfektion kan væsentligt påvirke de fysiske og kemiske egenskaber af materialet, hvilket påvirker dets styrke, ledningsevne eller reaktivitet.
Nøgleapplikationer:
* Farmaceutisk produktion: Krystallisation bruges til at rense og isolere aktive farmaceutiske ingredienser.
* Kemisk industri: Krystallisation bruges til at adskille og rense en lang række kemikalier.
* Materialvidenskab: Krystallisation anvendes til at skabe materialer med specifikke egenskaber til elektronik, optik og andre felter.
Ved at forstå disse principper kan forskere og ingeniører manipulere og kontrollere krystallisationsprocessen for at skabe krystaller med ønskede egenskaber til specifikke applikationer.
Sidste artikelHvilket metal er den næstbedste dirigent?
Næste artikelNår to atomer rører ved, hvordan kommunikeres det i kode?
 Varme artikler
Varme artikler
-
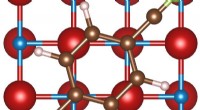 Solid-ion ledere for sikrere batterierInden for elektrokemi, det dendrit-undertrykkende domæne var endnu ikke blevet udforsket, selvom det dendrit-blokerende regime allerede var velkendt og undersøgt. Kredit:College of Engineering, Carneg
Solid-ion ledere for sikrere batterierInden for elektrokemi, det dendrit-undertrykkende domæne var endnu ikke blevet udforsket, selvom det dendrit-blokerende regime allerede var velkendt og undersøgt. Kredit:College of Engineering, Carneg -
 Bedre adsorption af kemomedicin på målrettede leveringskapslerKredit:CC0 Public Domain Effekten af kemoterapibehandling afhænger af, hvor effektivt den når kræftceller. Øget målrettet levering kan betyde faldende bivirkninger. Forskere forbedrer metoder ti
Bedre adsorption af kemomedicin på målrettede leveringskapslerKredit:CC0 Public Domain Effekten af kemoterapibehandling afhænger af, hvor effektivt den når kræftceller. Øget målrettet levering kan betyde faldende bivirkninger. Forskere forbedrer metoder ti -
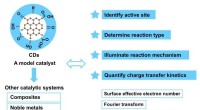 Avancerede multifunktionelle kulstofprikker i fotoelektrokemi-baseret energiomdannelseCarbon dots (CDer) kan bruges som en god modelkatalysator for TPV-testsystemer, og en række forskellige databehandlingsmetoder kan bruges til at opnå dybdegående forskning i det aktive sted, reaktions
Avancerede multifunktionelle kulstofprikker i fotoelektrokemi-baseret energiomdannelseCarbon dots (CDer) kan bruges som en god modelkatalysator for TPV-testsystemer, og en række forskellige databehandlingsmetoder kan bruges til at opnå dybdegående forskning i det aktive sted, reaktions -
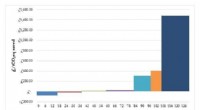 At bringe den kulstofreducerende koldsintringsproces ud af laboratorier og ind i keramikfremstillingKredit:University of Warwick En ny teknoøkonomisk analyse, af et hold ledet af en forsker fra WMG ved University of Warwick, viser, at den energiintensive keramiske industri ville opnå både økonom
At bringe den kulstofreducerende koldsintringsproces ud af laboratorier og ind i keramikfremstillingKredit:University of Warwick En ny teknoøkonomisk analyse, af et hold ledet af en forsker fra WMG ved University of Warwick, viser, at den energiintensive keramiske industri ville opnå både økonom
- Hvor meget energi bruges til produktion af bomuldspose?
- Analysen af butterfly chinua achebe?
- Hvorfor ligger den vernal equinox i Constellation of Aquarius?
- Ledende nanofiber netværk til fleksible, ubrydeligt, og gennemsigtige elektroder
- Florida sætter standarden for vandeffektivitet i syd
- Apple vs. Netflix, Disney:Vil bare skab arbejde for at overhale bulk i streamingkrigene?


