Hvilken type lys produceres, når elektroner kombineres med gasformig metaldamp?
Her er hvorfor:
* excitation: Elektronerne kolliderer med metalatomerne og overfører energi til dem. Denne energi ophidser metalatomerne og får deres elektroner til at hoppe til højere energiniveau.
* de-excitation: De ophidsede metalatomer er ustabile og frigiver hurtigt den absorberede energi ved at falde tilbage til deres jordtilstand. Denne energiudgivelse manifesterer sig som lette fotoner med specifikke bølgelængder.
* spektrum: Da energiniveauet inden for et metalatom kvantificeres, vil det udsendte lys være specifikke bølgelængder, hvilket resulterer i et karakteristisk emissionsspektrum for hvert metal.
Eksempler:
* natriumdamplamper: Natriumdamp udsender et lysegult lys på grund af emissionsspektret af natrium.
* neonskilte: Neongas udsender et karakteristisk rødt lys, når den er ophidset.
* spektroskopi: Analyse af et stofs emissionsspektrum kan bruges til at identificere dets sammensætning.
Så det lys, der produceres, når elektroner kombineres med gasformig metaldamp, er en bestemt type lys kaldet emissionsspektrum , som er unik for hvert metalelement.
 Varme artikler
Varme artikler
-
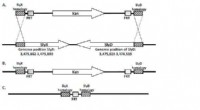 Nye teknologier til fremstilling af medicinske terapeutiske proteiner(A) KanR-kassetten flankeret af SlyX- og SlyD-homologe regioner. (B) Hele sekvensen af disse gener erstattes af KanR-kassetten under rekombination. (C) FRT ar er alt, hvad der er tilbage, når stamme
Nye teknologier til fremstilling af medicinske terapeutiske proteiner(A) KanR-kassetten flankeret af SlyX- og SlyD-homologe regioner. (B) Hele sekvensen af disse gener erstattes af KanR-kassetten under rekombination. (C) FRT ar er alt, hvad der er tilbage, når stamme -
 Forskere udvikler banebrydende røntgenteknik til at analysere gamle artefakterFotografier af arkæologiprøverne. Kredit:University of Leicester En banebrydende røntgenteknik, der kan analysere artefakter af enhver form eller tekstur på en ikke-destruktiv måde, er blevet udvi
Forskere udvikler banebrydende røntgenteknik til at analysere gamle artefakterFotografier af arkæologiprøverne. Kredit:University of Leicester En banebrydende røntgenteknik, der kan analysere artefakter af enhver form eller tekstur på en ikke-destruktiv måde, er blevet udvi -
 Grønt brint:Fokus på katalysatoroverfladenGrønt brint er et håb for energiomstillingen. Vellykket brug, imidlertid, kræver detaljeret forståelse af dets produktionsprocesser. Kredit:Pascal Armbruster, KIT Brug af energi fra solcellemodule
Grønt brint:Fokus på katalysatoroverfladenGrønt brint er et håb for energiomstillingen. Vellykket brug, imidlertid, kræver detaljeret forståelse af dets produktionsprocesser. Kredit:Pascal Armbruster, KIT Brug af energi fra solcellemodule -
 En miljøvenlig, lavprisløsning til spildevandsrensningKredit:somsak nitimongkolchai, Shutterstock Forskere udviklede et bæredygtigt spildevandsbehandlingssystem lavet af landbrugs- og industriaffald. Ifølge FNs skøn, to tredjedele af verdens befolkn
En miljøvenlig, lavprisløsning til spildevandsrensningKredit:somsak nitimongkolchai, Shutterstock Forskere udviklede et bæredygtigt spildevandsbehandlingssystem lavet af landbrugs- og industriaffald. Ifølge FNs skøn, to tredjedele af verdens befolkn
- Hvordan interagerer organismer nyttige og skadelige måder?
- Førerløse biler tvinger byer til at blive smarte
- Bedste amerikanske vejrsatellit nogensinde venter på solnedgang
- Nye spor dukker op i 30 år gammelt superledermysterium
- Hvilke af disse trin den videnskabelige metode involverer at angive et forhold, men ikke foreslå en…
- Udbrud af Alaskas Okmok-vulkan forbundet med en periode med ekstrem kulde i det gamle Rom


