Er phosphat en god varmeledning?
Her er hvorfor:
* struktur: Fosfater (som den almindelige fosfation Po₄⁻³) er generelt ioniske forbindelser. Ioniske forbindelser har en stiv krystallinsk struktur, hvor ioner holdes sammen af stærke elektrostatiske kræfter. Disse stærke kræfter begrænser den frie bevægelse af elektroner og vibrationer, som er nødvendige for effektiv varmeledning.
* Elektroner: Elektroner i ioniske forbindelser er tæt bundet til atomerne og er ikke let i stand til at bevæge sig frit for at bære varmeenergi.
* Termisk ledningsevne: Et stofs termiske ledningsevne er et mål for dets evne til at overføre varme. Ioniske forbindelser som fosfater har generelt lav termisk ledningsevne sammenlignet med metaller.
Eksempler:
* natriumphosphat (na₃po₄): Et almindeligt fosfatsalt, der bruges i forskellige anvendelser, herunder vaskemidler og fødevaretilsætningsstoffer. Det er en dårlig leder af varme.
* Calciumphosphat (CA₃ (PO₄) ₂): Hovedkomponenten i knogler og tænder. Det er ikke en god varmeleder.
I modsætning:
* Metaller: Metaller er fremragende ledere af varme, fordi de har et "hav" af frie elektroner, der let kan bevæge sig og bære varmeenergi.
Derfor er phosphat ikke en god varmeledning på grund af dets ioniske natur og den begrænsede bevægelse af elektroner inden for dens struktur.
 Varme artikler
Varme artikler
-
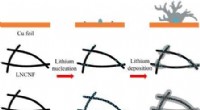 En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science
En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science -
 Forskere opdager, at trækul fanger ammoniakforureningRachel Hestrin (til højre) på beamlines ved canadian light Source sammen med Cornell-forsker Angela Possinger. Kredit:Canadian Light Source Cornell University-forskerne Rachel Hestrin og Johannes
Forskere opdager, at trækul fanger ammoniakforureningRachel Hestrin (til højre) på beamlines ved canadian light Source sammen med Cornell-forsker Angela Possinger. Kredit:Canadian Light Source Cornell University-forskerne Rachel Hestrin og Johannes -
 Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In
Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In -
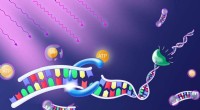 Programmering med lyskontaktenUdsættelse for lys frigiver molekylet ATP. Det giver energien til et enzym (blåt), der forbinder DNA-byggesten til en streng. Et andet enzym (grønt) adskiller strengen ved disse bindingssteder, sålede
Programmering med lyskontaktenUdsættelse for lys frigiver molekylet ATP. Det giver energien til et enzym (blåt), der forbinder DNA-byggesten til en streng. Et andet enzym (grønt) adskiller strengen ved disse bindingssteder, sålede
- Hvad er længdegrad og breddegrad for Gulf St Lawrence i Canada?
- Nedbør der synker ned i jorden kaldes?
- Ny type plast fremstillet af genvundet affald
- Opstår salterende ledning på grund af tilstedeværelsen af salt NaCl omkring neuron?
- Hvilken egenskab ved både langsgående og tværgående bølger øger mængden energi?
- Sådan lagres og få adgang til ligninger på en TI-83 Plus


