Hvorfor har gas ingen attraktiv kraft?
Her er en sammenbrud:
* ideel gasmodel: I den ideelle gasmodel behandles gasmolekyler som punktmasser uden volumen og ingen interaktioner mellem dem. Dette er en forenkling, der fungerer godt ved lave tryk og høje temperaturer.
* Ægte gasser: Ægte gasmolekyler har et lille volumen og oplever intermolekylære kræfter, omend svage. Disse kræfter skyldes primært:
* van der Waals Forces: Dette er svage, midlertidige attraktioner, der opstår fra udsving i elektronfordeling omkring molekyler. De er ansvarlige for kondensation af gasser i væsker.
* dipol-dipolinteraktioner: Disse forekommer mellem polære molekyler (molekyler med ujævn ladningsfordeling) og er stærkere end van der Waals -kræfter.
* Hvorfor er kræfterne svage i gasser?
* store afstande mellem molekyler: Gasmolekyler er langt fra hinanden sammenlignet med væsker og faste stoffer, så de attraktive kræfter er meget svagere.
* høj kinetisk energi: Gasmolekyler har høj kinetisk energi, som overvinder de svage attraktive kræfter, så de kan bevæge sig frit og hurtigt.
Sammenfattende har gasser attraktive kræfter, men de er svage sammenlignet med væsker og faste stoffer på grund af de store afstande mellem molekyler og deres høje kinetiske energi.
Det er vigtigt at bemærke, at:
* Styrken af intermolekylære kræfter øges, når gasmolekylerne kommer tættere sammen (f.eks. Ved højere tryk eller lavere temperatur).
* Nogle gasser, som brintgas (H2), har meget svage intermolekylære kræfter, hvilket får dem til at opføre sig næsten ideelt ved stuetemperatur.
* Den ideelle gasmodel er en nyttig tilnærmelse til mange praktiske anvendelser, men det er ikke en perfekt repræsentation af reel gasadfærd.
Sidste artikelHvilke oplysninger er de subatomære partikler givet med atomnummer?
Næste artikelHvad er den positronemission fra sølv 31?
 Varme artikler
Varme artikler
-
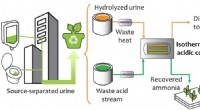 Bæredygtig genvinding af næringsstoffer fra urinUrin, som indeholder det meste af det nitrogen, der udskilles af mennesker, kan isoleres ved kilden via tørre urinaler og urinafledningstoiletter. Gennem isotermisk MD, flygtig ammoniak i hydrolyseret
Bæredygtig genvinding af næringsstoffer fra urinUrin, som indeholder det meste af det nitrogen, der udskilles af mennesker, kan isoleres ved kilden via tørre urinaler og urinafledningstoiletter. Gennem isotermisk MD, flygtig ammoniak i hydrolyseret -
 Oligomere materialer for at forbedre vandspaltningOligomer katalysator. Kredit:Marcos Gil-Sepulcre (ICIQ) Forskere fra Llobet-gruppen har udviklet et nyt molekylært materiale lavet af oligomerer og brugt det som en katalysator i vandoxidation, op
Oligomere materialer for at forbedre vandspaltningOligomer katalysator. Kredit:Marcos Gil-Sepulcre (ICIQ) Forskere fra Llobet-gruppen har udviklet et nyt molekylært materiale lavet af oligomerer og brugt det som en katalysator i vandoxidation, op -
 Brintbiler til masserne et skridt tættere på virkeligheden, takket være UCLA -opfindelsenRichard Kaner og Maher El-Kady på Kaners kontor. Kaner holder en kopi af en ny energilagrings- og konverteringsenhed, de udviklede. Kredit:Reed Hutchinson/UCLA UCLA forskere har designet en enhed,
Brintbiler til masserne et skridt tættere på virkeligheden, takket være UCLA -opfindelsenRichard Kaner og Maher El-Kady på Kaners kontor. Kaner holder en kopi af en ny energilagrings- og konverteringsenhed, de udviklede. Kredit:Reed Hutchinson/UCLA UCLA forskere har designet en enhed, -
 Kokosolieforbindelser frastøder insekter bedre end DEETEn Manila dværg kokospalme på grunden af Tropical Agriculture Research Station i Mayaguez, Puerto Rico. Kredit:Scott Bauer Forbindelser afledt af kokosolie er bedre end DEET til at frastøde blod
Kokosolieforbindelser frastøder insekter bedre end DEETEn Manila dværg kokospalme på grunden af Tropical Agriculture Research Station i Mayaguez, Puerto Rico. Kredit:Scott Bauer Forbindelser afledt af kokosolie er bedre end DEET til at frastøde blod
- Hvad er to atomenergi?
- Hvordan kan et teleskop se gennem tiden?
- Hvad er det enkle emne i denne sætning ud over store klipper i den fjerne strand en lille hule?
- Hvilken type energi opbevares i kernen et atom?
- Er jordpladernes hastighed meget langsom?
- Hvad er den kraft, der opstår, når et objekt skubber mod et andet objekt?


