Hvad sker der, når et brintatom skifter fra den ophidsede tilstand til jordtilstand?
1. Energiemission: Elektronet i den ophidsede tilstand har et højere energiniveau end i jordtilstanden. For at vende tilbage til jordtilstanden skal elektronet miste denne overskydende energi. Denne energi frigøres i form af en foton , en pakke elektromagnetisk stråling.
2. Fotonegenskaber: Energien fra den udsendte foton er nøjagtigt lig med forskellen i energi mellem den ophidsede tilstand og jordtilstanden. Denne energiforskel bestemmer frekvens og bølgelængde af den udsendte foton.
3. Spektrale linjer: De udsendte fotoner kan observeres som spektrale linjer I det elektromagnetiske spektrum. Hver overgang mellem specifikke energiniveauer svarer til en unik spektrallinje. Dette er grundlaget for atomspektroskopi , som giver forskere mulighed for at identificere elementer og studere deres egenskaber.
4. Afslapning: Efter at have udsendt fotonen, sætter elektronen sig ned i jordtilstanden, det laveste energiniveau. Dette er den mest stabile konfiguration for hydrogenatomet.
Kortfattet:
* Elektronet mister energi.
* En foton udsendes.
* Den udsendte foton har specifik energi, frekvens og bølgelængde.
* Hydrogenatomet vender tilbage til sin jordtilstand.
Denne proces er grundlæggende for at forstå atomernes opførsel og interaktioner mellem lys og stof.
Sidste artikelHvorfor bruges vand som kølemiddel til nogle atomreaktorer?
Næste artikelHvad er fakta om elektroner?
 Varme artikler
Varme artikler
-
 Supramolekylære materialer med en tidskontaktForskere ved det tekniske universitet München (TUM) har nu med succes udviklet supramolekylære materialer, der går i opløsning på et forudbestemt tidspunkt. Som et eksempel danner disse Fmoc-tripeptid
Supramolekylære materialer med en tidskontaktForskere ved det tekniske universitet München (TUM) har nu med succes udviklet supramolekylære materialer, der går i opløsning på et forudbestemt tidspunkt. Som et eksempel danner disse Fmoc-tripeptid -
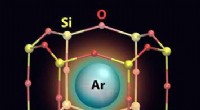 Studerer argongas fanget i todimensionel række små bureEn kunstnerisk gengivelse af et argon (Ar) atom fanget i et nanocage, der har en silicium (Si) -oxygen (O) ramme. Kredit:Brookhaven National Laboratory Forskere ved US Department of Energys (DOE)
Studerer argongas fanget i todimensionel række små bureEn kunstnerisk gengivelse af et argon (Ar) atom fanget i et nanocage, der har en silicium (Si) -oxygen (O) ramme. Kredit:Brookhaven National Laboratory Forskere ved US Department of Energys (DOE) -
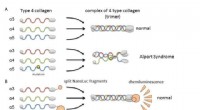 Et meget følsomt og multianalytisk system til arvelig nyresygdom(A) Kollagen IV alfa-3, alfa-4, og alfa-5 danner normalt komplekser (trimere) og bliver bestanddele af basalmembranen i nyren. Ved Alport syndrom, genetisk mutation i en af kæderne forstyrrer trimer
Et meget følsomt og multianalytisk system til arvelig nyresygdom(A) Kollagen IV alfa-3, alfa-4, og alfa-5 danner normalt komplekser (trimere) og bliver bestanddele af basalmembranen i nyren. Ved Alport syndrom, genetisk mutation i en af kæderne forstyrrer trimer -
 Gennembrud i undersøgelsen af det enzym, der i sidste ende producerer fiskelugtssyndromKredit:University of Warwick Fiskelugtssyndrom (trimethylaminuri) er en invaliderende sygdom, hvor leveren ikke kan nedbryde det ildelugtende kemiske trimethylamin, der produceres af enzymer fra b
Gennembrud i undersøgelsen af det enzym, der i sidste ende producerer fiskelugtssyndromKredit:University of Warwick Fiskelugtssyndrom (trimethylaminuri) er en invaliderende sygdom, hvor leveren ikke kan nedbryde det ildelugtende kemiske trimethylamin, der produceres af enzymer fra b
- Hvilket lag af jorden indeholder tektoniske plader?
- Hvorfor påvirkede formørkelser tidevandet?
- Hvilket grundstof har samme valenselektronkonfiguration som fosfor?
- Hvad er tilstanden af materie calciumhydroxid?
- Mikro til makrokortlægning-observation af tidligere landskaber via fjernmåling
- Hvornår bruges udtrykket negativ acceleration?


