Hvordan er temperaturen på en gas relateret til dens tryk?
pv =nrt
Hvor:
* p er gasens tryk
* v er volumen af gassen
* n er antallet af mol gas
* r er den ideelle gaskonstant
* t er temperaturen på gassen i Kelvin
Sådan fungerer forholdet:
* Direkte proportionalitet: Ligningen viser, at tryk (p) og temperatur (t) er direkte proportional, når volumen (v) og antallet af mol (n) holdes konstant. Dette betyder, at hvis du øger temperaturen på en gas, vil dens tryk også stige proportionalt.
* molekylær bevægelse: Temperaturen på en gas er et mål for den gennemsnitlige kinetiske energi for dens molekyler. Når temperaturen stiger, bevæger gasmolekylerne sig hurtigere og kolliderer med væggene i deres beholder oftere og med større kraft. Denne øgede kollisionshastighed resulterer i højere pres.
Eksempler:
* oppustning af et dæk: Når du pumper luft ind i et dæk, øger du presset. Luften inde i dækket bliver også varmere, fordi luftmolekylerne komprimeres og bevæger sig hurtigere.
* Opvarmning af en ballon: Hvis du opvarmer en ballon fyldt med luft, udvides luften inde. Dette skyldes, at luftmolekylerne får energi og bevæger sig hurtigere, hvilket får ballonen til at udvide og øge trykket inde.
Vigtig note:
* Den ideelle gaslov er en forenkling og beskriver ikke perfekt opførsel af alle gasser, især ved høje tryk eller lave temperaturer. Det giver dog en god tilnærmelse til mange situationer.
 Varme artikler
Varme artikler
-
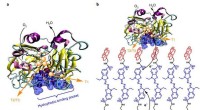 Forbedring af elektronoverførsel i enzymatiske biobrændselscellerDen som designet poly(pyrr)–ABTS–pyr film. en, Repræsentationer af Trametes versicolor Lac med den hydrofobe bindingslomme orienteret mod bunden af siden og T1 kobberstedet placeret på den ene side
Forbedring af elektronoverførsel i enzymatiske biobrændselscellerDen som designet poly(pyrr)–ABTS–pyr film. en, Repræsentationer af Trametes versicolor Lac med den hydrofobe bindingslomme orienteret mod bunden af siden og T1 kobberstedet placeret på den ene side -
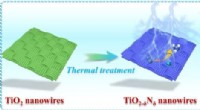 Overfladedefektkonstruktion af nanowire-arrays mod effektiv nitrogenreduktion til ammoniaksynteseKatalysatorerne er baseret på TiO2−δ Nδ nanotråde dyrket på kulstof har et højere udbytte for ammoniak end elektrokatalysatoren uden N-doping. Kredit:Journal of Energy Chemistry Ammoniak er en kul
Overfladedefektkonstruktion af nanowire-arrays mod effektiv nitrogenreduktion til ammoniaksynteseKatalysatorerne er baseret på TiO2−δ Nδ nanotråde dyrket på kulstof har et højere udbytte for ammoniak end elektrokatalysatoren uden N-doping. Kredit:Journal of Energy Chemistry Ammoniak er en kul -
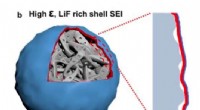 Et nyt elektrolytdesign, der kunne forbedre ydeevnen af Li-ion-batterierBillede, der viser en Si-partikel dækket af den LiF-rige SEI. Kredit:Chen et al. De fleste eksisterende lithium-ion-batterier (LIBer) integrerer grafitanoder, som har en kapacitet på cirka 350 mil
Et nyt elektrolytdesign, der kunne forbedre ydeevnen af Li-ion-batterierBillede, der viser en Si-partikel dækket af den LiF-rige SEI. Kredit:Chen et al. De fleste eksisterende lithium-ion-batterier (LIBer) integrerer grafitanoder, som har en kapacitet på cirka 350 mil -
 Ny hybridelektrolyt til højtydende Li-ion-batterierEt fotografi (venstre), henholdsvis et scanningselektronmikroskopbillede (i midten) og en skematisk illustration af sammensat elektrolytstruktur (til højre). Kredit:Grewal og Yabu. Li-ion-batterier
Ny hybridelektrolyt til højtydende Li-ion-batterierEt fotografi (venstre), henholdsvis et scanningselektronmikroskopbillede (i midten) og en skematisk illustration af sammensat elektrolytstruktur (til højre). Kredit:Grewal og Yabu. Li-ion-batterier


