Hvad er forskellen mellem emission og absorption med hensyn til hvad der sker med et elektronatom?
Absorption:
* Hvad sker der: En elektron får energi Ved at absorbere en foton (en pakke lysenergi).
* Energiniveau: Elektronet hopper fra et lavere energiniveau til et højere energiniveau inden for atomet.
* Resultat: Atomet er nu i en ophidset tilstand .
Emission:
* Hvad sker der: En elektron mister energi Ved at udsende en foton.
* Energiniveau: Elektronet falder fra et højere energiniveau til et lavere energiniveau inden for atomet.
* Resultat: Atomet vender tilbage til en mere stabil, lavere energistilstand , og lys udsendes.
Visualisering af forskellen:
Forestil dig en elektron som en bold på en trappe.
* Absorption: Bolden absorberer energi og springer op til et højere trin på trappen.
* Emission: Bolden mister energi og falder ned til et lavere trin på trappen.
Nøglepunkter:
* Energibesparelse: Begge processer overholder princippet om energibesparelse. Den energi, der er absorberet eller udsendt af elektronet, er nøjagtigt lig med energien fra den involverede foton.
* specifikke frekvenser: Hvert element har unikke energiniveau, hvilket betyder, at det absorberer og udsender lys ved specifikke frekvenser (farver). Det er dette, der giver elementer deres karakteristiske spektrale linjer.
* applikationer: Disse processer er grundlæggende for forskellige teknologier, herunder lasere, spektroskopi og fluorescerende belysning.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse aspekter!
Sidste artikelHvad er eksempler på termisk ekspansion en væske?
Næste artikelHvilke to ting sker med partikler i et stof, når de opvarmes?
 Varme artikler
Varme artikler
-
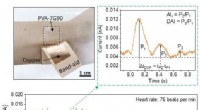 Opfindelsen tilbyder en ny mulighed for overvågning af hjertesundhedEt team fra Purdue University udviklede selvdrevne bærbare triboelektriske nanogeneratorer med polyvinylalkohol-baserede kontaktlag til overvågning af kardiovaskulær sundhed. Kredit:Wenzhuo Wu/Purdue
Opfindelsen tilbyder en ny mulighed for overvågning af hjertesundhedEt team fra Purdue University udviklede selvdrevne bærbare triboelektriske nanogeneratorer med polyvinylalkohol-baserede kontaktlag til overvågning af kardiovaskulær sundhed. Kredit:Wenzhuo Wu/Purdue -
 Cellulose til fremstilling af avancerede materialerErlantz Lizundia – Fernandez. Kredit:UPV/EHU. Det sidste årti har oplevet en stigning i videnskabelige publikationer og patenter på cellulose, den mest almindelige naturlige polymer. Ved at gennem
Cellulose til fremstilling af avancerede materialerErlantz Lizundia – Fernandez. Kredit:UPV/EHU. Det sidste årti har oplevet en stigning i videnskabelige publikationer og patenter på cellulose, den mest almindelige naturlige polymer. Ved at gennem -
 Forskere nedbryder plastikaffaldDesign af en sterisk indesluttet bipyridin-ruthenium (Ru) ramme tillader kontrolleret indeslutning af adsorberet H2 og dets levering til inerte amider, hvilket muliggør katalytisk hydrogenering af en
Forskere nedbryder plastikaffaldDesign af en sterisk indesluttet bipyridin-ruthenium (Ru) ramme tillader kontrolleret indeslutning af adsorberet H2 og dets levering til inerte amider, hvilket muliggør katalytisk hydrogenering af en -
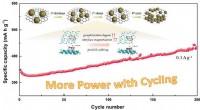 Partikelforfining inducerer og øger cykluskapaciteten af natrium/lithium-ion-batterierSkematisk diagram af mekanismen for partikelforfining for at inducere forøgelse af cykluskapaciteten af SIBer. Kredit:WANG Canpei Natriumionbatterier (SIBer) har tiltrukket bred opmærksomhed på
Partikelforfining inducerer og øger cykluskapaciteten af natrium/lithium-ion-batterierSkematisk diagram af mekanismen for partikelforfining for at inducere forøgelse af cykluskapaciteten af SIBer. Kredit:WANG Canpei Natriumionbatterier (SIBer) har tiltrukket bred opmærksomhed på
- Hvad er 3 eksempler på gravitationsenergi?
- Hvad ville der ske, hvis solen skinnede hele tiden?
- Hvor hurtigt kommer luft ud af en stående ventilator?
- Hvor lang tid tager disse planet Jorden til at kredse solen?
- Ny rapport undersøger folks holdning til klimaændringer, og hvordan dette omsættes til handling
- Menneskelig evolution:tilbage til træerne?


