Hvilket eksperiment overbeviste Ernest Snarereford om, at atomet har en koppositivt ladet kerne?
Her er en sammenbrud af eksperimentet og dets betydning:
eksperimentet:
1. opsætning: Rutherford og hans team bombarderede et tyndt ark guldfolie med alfa -partikler (positivt ladede partikler udsendt af radioaktive stoffer).
2. Forventning: Baseret på den fremherskende "blommepudding -model" af atomet, som antydede en ensartet fordeling af positive og negative ladninger, forventede de, at alfa -partiklerne ville passere lige gennem folien med minimal afvigelse.
3. observationer: Til deres overraskelse gik de fleste alfapartikler lige igennem, men en lille brøkdel blev afbøjet i store vinkler, og nogle sprang endda tilbage direkte mod kilden.
Fortolkningen:
Rutherford fortolkede disse uventede resultater som følger:
* et tæt, positivt ladet center: De store afbøjninger og bagudspredning kunne kun forklares, hvis der var en meget koncentreret positiv ladning i atomet. Denne afgift, begrundede han, skal opholde sig i en lille, tæt kerne, som han navngav "kernen".
* tomt rum: Det faktum, at de fleste alfa -partikler passerede lige gennem, indikerede, at atomet for det meste er tomt rum.
Betydningen:
Guldfolieeksperimentet væltede atomets fremherskende model fuldstændigt. Rutherfords model, der foreslog en lille, positivt ladet kerne omgivet af negativt ladede elektroner, blev grundlaget for moderne atomteori.
Dette eksperiment var en vartegn opdagelse, der førte til en dybere forståelse af atomets struktur og banede vejen for yderligere forskning inden for nuklear fysik.
Sidste artikelHvad er sandt med alle nukleare reaktioner?
Næste artikelSubatomære partikler findes i hvert atom?
 Varme artikler
Varme artikler
-
 Aktiv maskinlæring til opdagelse og krystallisering af gigantiske polyoxometalatmolekylerKredit:Wiley Hvem er den bedre eksperimenterende, et menneske eller en robot? Når det kommer til at udforske syntetiske og krystallisationsbetingelser for uorganiske gigantiske molekyler, aktivt l
Aktiv maskinlæring til opdagelse og krystallisering af gigantiske polyoxometalatmolekylerKredit:Wiley Hvem er den bedre eksperimenterende, et menneske eller en robot? Når det kommer til at udforske syntetiske og krystallisationsbetingelser for uorganiske gigantiske molekyler, aktivt l -
 Del og erobre:Forskere finder nøglen til at skabe bedre medicin med færre bivirkningerChiralt molekyle. Kredit:Palitel og Naaman. I dag, en ny undersøgelse offentliggjort i Videnskab af professorer Yossi Paltiel fra det hebraiske universitet i Jerusalem og Ron Naaman fra Weizmann
Del og erobre:Forskere finder nøglen til at skabe bedre medicin med færre bivirkningerChiralt molekyle. Kredit:Palitel og Naaman. I dag, en ny undersøgelse offentliggjort i Videnskab af professorer Yossi Paltiel fra det hebraiske universitet i Jerusalem og Ron Naaman fra Weizmann -
 Rumtemperaturbundet grænseflade forbedrer afkøling af galliumnitrid-enhederTværsnit af lysfelt højopløsnings STEM-billeder af GaN-diamant-grænseflader bundet ved overfladeaktiveret bindingsteknik. Kredit:Zhe Cheng, Georgia Tech En rumtemperaturbindingsteknik til at integ
Rumtemperaturbundet grænseflade forbedrer afkøling af galliumnitrid-enhederTværsnit af lysfelt højopløsnings STEM-billeder af GaN-diamant-grænseflader bundet ved overfladeaktiveret bindingsteknik. Kredit:Zhe Cheng, Georgia Tech En rumtemperaturbindingsteknik til at integ -
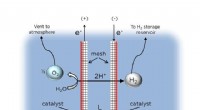 Ingeniører udvikler flydende solbrændstofrigg til havvandselektrolyseTo meshelektroder holdes i en smal adskillelsesafstand (L), og genererer H2- og O2 -gasser samtidigt. Den centrale innovation er den asymmetriske placering af katalysatoren på de udadvendte overflader
Ingeniører udvikler flydende solbrændstofrigg til havvandselektrolyseTo meshelektroder holdes i en smal adskillelsesafstand (L), og genererer H2- og O2 -gasser samtidigt. Den centrale innovation er den asymmetriske placering af katalysatoren på de udadvendte overflader
- Teamet udvikler metode til neurale netberegninger i vand
- Undersøgelse identificerer Californiens klipper med risiko for sammenbrud
- På jagt efter stabile væsker
- Igneous klipper, der resulterer, når lava størkner, klassificeres som hvad?
- Arbejde er overførslen af magt fra et objekt til et andet?
- Hvor findes bjerge i jordens lag?


