Hvordan beslutter du, om en prøve af stof er fast væske eller gas?
1. Form og volumen
* faste stoffer: Har en bestemt form og et bestemt volumen. De opretholder deres form og volumen, selv når de flyttes til en anden beholder.
* væsker: Har et bestemt volumen, men tag formen på deres beholder. De vil fylde bunden af en beholder, men udvides ikke nødvendigvis for at fylde hele beholderen.
* Gasser: Har ingen bestemt form eller volumen. De vil udvide til at fylde hele beholderen, de er placeret i.
2. Kompressibilitet
* faste stoffer: Generelt ikke komprimerbar. Deres molekyler er tæt pakket og modstår at blive presset tættere sammen.
* væsker: Lidt komprimerbar. Deres molekyler er tættere sammen end gasmolekyler, men har stadig noget mellemrum mellem dem.
* Gasser: Meget komprimerbar. Deres molekyler er langt fra hinanden og kan presses tættere sammen.
3. Flow
* faste stoffer: Flyd ikke. De opretholder deres form og modstår deformation.
* væsker: Flow let. De tager formen på deres beholder og kan hældes.
* Gasser: Flow let. De udvides til at fylde deres beholder og kan let komprimeres.
4. Andre egenskaber
* densitet: Faststoffer har generelt højere densiteter end væsker, som har højere densiteter end gasser.
* termisk ekspansion: Solids, liquids, and gases all expand when heated, but gases expand the most.
Eksempler
* fast: Rock, is, træ
* væske: Vand, olie, kviksølv
* gas: Luft, ilt, kuldioxid
Husk:
* Stofstilstanden kan ændre sig med temperatur og tryk. For eksempel kan vand eksistere som en fast (is), en væske (vand) eller en gas (damp).
* Der er nogle undtagelser fra disse generelle regler, men de giver et godt udgangspunkt for at forstå forskellene mellem faste stoffer, væsker og gasser.
 Varme artikler
Varme artikler
-
 Ultralydsteknik afslører identiteten af grafitFigur 1. Tværsnits-scanningselektronmikrografibilleder af prøve G2800 (øverst) og en meget orienteret pyrolytisk grafit (HOPG) -prøve (nederst). (Kaneka Corporation, Materialer til fysisk gennemgang (
Ultralydsteknik afslører identiteten af grafitFigur 1. Tværsnits-scanningselektronmikrografibilleder af prøve G2800 (øverst) og en meget orienteret pyrolytisk grafit (HOPG) -prøve (nederst). (Kaneka Corporation, Materialer til fysisk gennemgang ( -
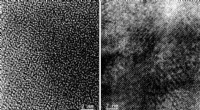 Forskere bruger en ny metode til at lave lovende batterimaterialeBilleder fremstillet ved transmissionselektronmikroskopi bekræftede transformationen af elektrodematerialet fra et uordnet arrangement af atomer (til venstre) til en ordnet, krystallinsk struktur (h
Forskere bruger en ny metode til at lave lovende batterimaterialeBilleder fremstillet ved transmissionselektronmikroskopi bekræftede transformationen af elektrodematerialet fra et uordnet arrangement af atomer (til venstre) til en ordnet, krystallinsk struktur (h -
 Kemikere er i stand til at fremkalde ensartet kiralitetKredit:CC0 Public Domain Chiralitet er en grundlæggende egenskab for mange organiske molekyler og betyder, at kemiske forbindelser ikke kun kan forekomme i én form, men også i to spejlbilledformer
Kemikere er i stand til at fremkalde ensartet kiralitetKredit:CC0 Public Domain Chiralitet er en grundlæggende egenskab for mange organiske molekyler og betyder, at kemiske forbindelser ikke kun kan forekomme i én form, men også i to spejlbilledformer -
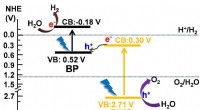 Ultratyndt sort fosfor til solcelledrevet brintøkonomiFig.1. Skematisk diagram over Z-skema fotokatalytisk overordnet vandopdeling ved hjælp af BP/BiVO4 under bestråling af synligt lys. Kredit:Osaka University Brint som brændstofkilde, frem for kulbr
Ultratyndt sort fosfor til solcelledrevet brintøkonomiFig.1. Skematisk diagram over Z-skema fotokatalytisk overordnet vandopdeling ved hjælp af BP/BiVO4 under bestråling af synligt lys. Kredit:Osaka University Brint som brændstofkilde, frem for kulbr
- Er livets træ det samme som Knowlegde?
- Hvad er et ark som krop, der skærer på tværs af klippelag og produceres, når magma indsprøjtes …
- Forskydningskraft:Hvor gode materialer bliver gjort bedre
- Definition af Abiotiske ressourcer
- Arven fra gamle istider former, hvordan søgræs reagerer på miljøtrusler i dag
- Hvad fortæller kraften i en maskine dig?


