Hvad er hovedpunkterne i nuklear model et atom?
1. Atom har en tæt, positivt ladet kerne:
- Atomet er ikke en solid sfære, men indeholder et lille, positivt ladet center kaldet kernen.
- Næsten al masse af atomet er koncentreret i kernen.
2. Elektroner kredser om kernen:
- Negativt ladede elektroner kredserer kernen på specifikke stier eller energiniveau.
- Disse kredsløb er ikke faste stier, men snarere regioner i rummet, hvor elektronet mest sandsynligt findes.
3. Tom mellemrum mellem kernen og elektronerne:
- Atomet er for det meste tomt rum med en meget lille, tæt kerne i midten.
4. Nucleus indeholder protoner og neutroner:
- Kernen er sammensat af protoner og neutroner.
- Protoner er positivt ladede partikler, mens neutroner ikke har nogen gebyr.
- Antallet af protoner (atomnummer) bestemmer elementet.
- Det samlede antal protoner og neutroner (masseantal) bestemmer isotopen af et element.
5. Elektrostatisk kraft holder atomet sammen:
- Tiltrækningen mellem de positivt ladede protoner og de negativt ladede elektroner er det, der holder atomet sammen.
Nøgleforskelle fra tidligere modeller:
* Thomsons Plum Pudding Model: Denne model foreslog en positivt ladet sfære med elektroner indlejret i den. Rutherfords model modbevisede dette og viste, at den positive ladning er koncentreret i kernen.
* Daltons atommodel: Denne model betragtede atomer som udelelige sfærer. Rutherfords model udvidede dette og demonstrerede den interne struktur af atomer.
Yderligere fremskridt:
* Bohr Model: Raffineret modellen med specifikke energiniveauer for elektroner, men var begrænset til kun at forklare hydrogenatomer.
* kvantemekanisk model: Udskiftede de faste kredsløb med sandsynlighedsfordelinger af elektronplacering, hvilket gav et mere nøjagtigt og komplekst billede af atomet.
Generelt revolutionerede den nukleare model vores forståelse af atomstruktur. Det lagde grundlaget for yderligere fremskridt i atomteori og er stadig grundlaget for at forstå atomernes opførsel.
Sidste artikelHvordan løser du Tjernobyl?
Næste artikelHvad er densiteten af flydende aluminium?
 Varme artikler
Varme artikler
-
 Hvordan fælles elementer kan gøre en mere energisikker fremtidEt epitaxy-system med molekylær stråle lægger hvert atomlag af forbindelsen ned systematisk, så forskere kan studere det tynde lag, eller film, struktur, når de vokser den. Kredit:Durbin Lab Tyndf
Hvordan fælles elementer kan gøre en mere energisikker fremtidEt epitaxy-system med molekylær stråle lægger hvert atomlag af forbindelsen ned systematisk, så forskere kan studere det tynde lag, eller film, struktur, når de vokser den. Kredit:Durbin Lab Tyndf -
 Datadeling er fremtiden for materialeforskningKredit: Avanceret Videnskab Brug af data til at designe og udvikle helt nye materialer er et hastigt voksende videnskabsområde. En gruppe forskere ved Aalto-universitetet har netop offentliggjort
Datadeling er fremtiden for materialeforskningKredit: Avanceret Videnskab Brug af data til at designe og udvikle helt nye materialer er et hastigt voksende videnskabsområde. En gruppe forskere ved Aalto-universitetet har netop offentliggjort -
 En første af sin slags katalysator efterligner naturlige processer til at nedbryde plast og produce…Kredit:Unsplash/CC0 Public Domain Mens genbrug af plast ikke er ny videnskab, nuværende processer gør det ikke økonomisk umagen værd - plastaffald bliver down-cycled til lavere kvalitet, mindre br
En første af sin slags katalysator efterligner naturlige processer til at nedbryde plast og produce…Kredit:Unsplash/CC0 Public Domain Mens genbrug af plast ikke er ny videnskab, nuværende processer gør det ikke økonomisk umagen værd - plastaffald bliver down-cycled til lavere kvalitet, mindre br -
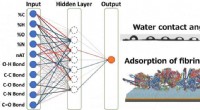 Et spring fremad for design af biomaterialer ved hjælp af AIKunstig neural netværksmodel, der bruges i dette arbejde Kredit: ACS Biomaterials Science &Engineering Forskere ved Tokyo Institute of Technology (Tokyo Tech) har brugt kunstig intelligens (AI) t
Et spring fremad for design af biomaterialer ved hjælp af AIKunstig neural netværksmodel, der bruges i dette arbejde Kredit: ACS Biomaterials Science &Engineering Forskere ved Tokyo Institute of Technology (Tokyo Tech) har brugt kunstig intelligens (AI) t
- Hvilken slags fysisk mængde er en stress?
- En ny tilgang til ultrahurtige lysimpulser
- Hvor meget af Suns Energy absorberes af land og oceaner?
- Hvad er den energi, der overføres fra et varmere objekt til køligere, kaldet?
- Fysiske og kemiske egenskaber ved natriumbicarbonat
- Hvad får et træ til at blive forstenet?


