Hvad viser forholdet mellem tryk og volumen af en gas i henhold til loven?
Boyle's lov siger, at presset fra en given masse af en ideel gas er omvendt proportional med dens volumen ved en konstant temperatur.
Dette betyder, at når volumenet af en gas falder, øges dets tryk proportionalt, og omvendt. Matematisk kan dette udtrykkes som:
P₁V₁ =P₂V₂
Hvor:
* p₁ er det oprindelige pres
* V₁ er det oprindelige bind
* p₂ er det endelige pres
* V₂ er det endelige bind
Eksempel:
Hvis du fordobler volumenet af en gas, mens du holder temperaturen konstant, halveres trykket. Omvendt, hvis du halverer lydstyrken, vil trykket fordobles.
Grafisk repræsentation:
Boyle's lov kan grafisk repræsenteres ved at planlægge pres mod volumen. Grafen vil være en hyperbola, der angiver det omvendte forhold mellem de to variabler.
Vigtige noter:
* Boyle's lov gælder kun for ideelle gasser. Ægte gasser kan afvige lidt fra denne lov ved højt tryk og lave temperaturer.
* Gassens temperatur skal være konstant for Boyle's lov for at være sandt.
* Gassens masse skal også forblive konstant.
Anvendelser af Boyle's lov:
Boyle's lov har mange praktiske applikationer, herunder:
* scuba dykning: Dykkere skal forstå forholdet mellem tryk og volumen for at justere deres åndedrætsapparat, når de falder ned.
* Medicinsk udstyr: Nogle medicinske udstyr, såsom sprøjter og forstøvere, er afhængige af Boyle's lov til at fungere.
* Industrielle processer: Boyle's lov bruges i mange industrielle processer, der involverer gasser, såsom gaskomprimering og opbevaring.
 Varme artikler
Varme artikler
-
 Effektiv, stabilt termoelektrisk modul baseret på højtydende væskelignende materialerKredit:CC0 Public Domain Baseret på højtydende væskelignende materialer, videnskabsmænd fra Shanghai Institute of Ceramics ved det kinesiske videnskabsakademi og Northwestern University i USA frem
Effektiv, stabilt termoelektrisk modul baseret på højtydende væskelignende materialerKredit:CC0 Public Domain Baseret på højtydende væskelignende materialer, videnskabsmænd fra Shanghai Institute of Ceramics ved det kinesiske videnskabsakademi og Northwestern University i USA frem -
 De energimæssige implikationer af organiske radikale polymererDr. Jodie L. Lutkenhaus Kredit:Texas A&M University College of Engineering Texas A&M University professor Dr. Jodie L. Lutkenhaus er et skridt tættere på at realisere sit mål om at skabe et batter
De energimæssige implikationer af organiske radikale polymererDr. Jodie L. Lutkenhaus Kredit:Texas A&M University College of Engineering Texas A&M University professor Dr. Jodie L. Lutkenhaus er et skridt tættere på at realisere sit mål om at skabe et batter -
 Opdagelse af ny COVID-infektionsmekanisme giver et fingerpeg om SARS-CoV-2-spring til menneskerKreativ gengivelse af SARS-CoV-2-partikler (ikke i skala). Kredit:National Institute of Allergy and Infectious Diseases, NIH Den originale SARS-CoV-2-virusstamme, der dukkede op i begyndelsen af
Opdagelse af ny COVID-infektionsmekanisme giver et fingerpeg om SARS-CoV-2-spring til menneskerKreativ gengivelse af SARS-CoV-2-partikler (ikke i skala). Kredit:National Institute of Allergy and Infectious Diseases, NIH Den originale SARS-CoV-2-virusstamme, der dukkede op i begyndelsen af -
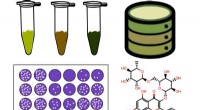 Et stof, der findes i brunkul, kan hjælpe med at bekæmpe viraAntiviral aktivitet af ti humusstofprøver (HS) blev vurderet mod flåtbåren encephalitisvirus reproduktion. For at afsløre mulige aktive komponenter i HS -prøver blev der søgt efter FTICR MS -data i Ch
Et stof, der findes i brunkul, kan hjælpe med at bekæmpe viraAntiviral aktivitet af ti humusstofprøver (HS) blev vurderet mod flåtbåren encephalitisvirus reproduktion. For at afsløre mulige aktive komponenter i HS -prøver blev der søgt efter FTICR MS -data i Ch
- Hvordan findes den resulterende hastighed, når du kombinerer 2 hastigheder, der går i modsatte ret…
- Hvad er en almindelig Devonian fossil?
- Hvorfor kræves ilt i biologiske systemer?
- Nanomesh-lægemiddellevering giver håb mod global antibiotikaresistens
- Prioriterer kunstmuseerne de besøgendes trivsel nok?
- Hvilke organismer deler sig ved spaltning Furrow?


