Ved en bestemt temperatur er pH af neutral opløsning 7,56 hvilken værdi kW ved den temperatur?
Forståelse af PH, POH og KW
* ph: Et mål for surhedsgraden eller alkaliniteten af en opløsning. Det er den negative logaritme (base 10) af hydrogenionkoncentrationen ([H+]).
* POH: I lighed med pH, men det måler koncentrationen af hydroxidioner ([OH-]).
* kW: Ionproduktkonstanten for vand. Det repræsenterer ligevægtskonstanten til autoionisering af vand:
H₂O (L) ⇌ H⁺ (aq) + OH⁻ (aq)
Kw =[h⁺] [oh⁻]
Forholdet mellem pH, POH og KW
* For en neutral opløsning, [h⁺] =[oh⁻].
* Ph + POH =14 (ved 25 ° C)
* Kw =[h⁺] [oh⁻] =10⁻¹⁴ (ved 25 ° C)
Løsning af problemet
1. Find POH: Da pH er 7,56, kan vi finde POH ved hjælp af forholdet:
POH =14 - pH =14 - 7,56 =6,44
2. Beregn [H⁺] og [OH⁻]:
[H⁺] =10⁻⁷.⁵⁶
[OH⁻] =10⁻⁶.⁴⁴
3. Bestem kW:
Kw =[h⁺] [oh⁻] =(10⁻⁷.⁵⁶) (10⁻⁶.⁴⁴) =10⁻¹⁴
Derfor er værdien af KW ved denne temperatur 10⁻¹⁴.
Vigtig note: Mens forholdet mellem PH, POH og KW normalt er 14 ved 25 ° C, ændres det med temperaturen. Temperaturen i dette problem er ikke specificeret, så vi antager, at det er en anden temperatur, hvor den neutrale pH er 7,56, men KW -værdien forbliver den samme.
Sidste artikelHvorfor er vand så vigtigt molekyle?
Næste artikelHvad er de fire vigtigste organiske molekyler, der er vigtige hos mennesker?
 Varme artikler
Varme artikler
-
 Forskere har fundet en måde at skabe lægemiddelmolekyler ud fra kulilteResultaterne af atomeffektivitetsreaktioner. Kredit:Denis Chusov Forskere fra RUDN Universitet har i samarbejde med russiske og udenlandske kolleger studeret reduktive amineringsreaktioner. De nye
Forskere har fundet en måde at skabe lægemiddelmolekyler ud fra kulilteResultaterne af atomeffektivitetsreaktioner. Kredit:Denis Chusov Forskere fra RUDN Universitet har i samarbejde med russiske og udenlandske kolleger studeret reduktive amineringsreaktioner. De nye -
 Enkeltpartikelundersøgelser peger vejen mod næste generation af lysskærmeKredit:University of Tsukuba Holografiske skærme hjælper med at tilføje en tredimensionel – og dermed mere naturtro – følelse til det, der ellers ville fremstå som et todimensionelt billede. Nu, f
Enkeltpartikelundersøgelser peger vejen mod næste generation af lysskærmeKredit:University of Tsukuba Holografiske skærme hjælper med at tilføje en tredimensionel – og dermed mere naturtro – følelse til det, der ellers ville fremstå som et todimensionelt billede. Nu, f -
 Makromolekylær krystallografi kaster lys over en ny måde at målrette mod malariaparasittenKrystalstruktur af Cryptosporidium parvum Lysyl tRNA-synthetase (CpKRS) bundet til et nyt lille molekyle, der er aktivt mod apicomplexan-parasitterne Plasmodium falciparum og Cryptosporidium parvum.
Makromolekylær krystallografi kaster lys over en ny måde at målrette mod malariaparasittenKrystalstruktur af Cryptosporidium parvum Lysyl tRNA-synthetase (CpKRS) bundet til et nyt lille molekyle, der er aktivt mod apicomplexan-parasitterne Plasmodium falciparum og Cryptosporidium parvum. -
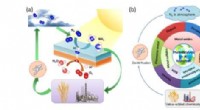 Fotokemisk nitrogenfiksering – åbner nye udsigter mod en bæredygtig energifremtid(a) En oversigt over N2-kredsløbet og cirkulationen af N2 i forskellige former. (b) Illustration af den avancerede forskning i udviklingen af fotokatalysatorer til N2-fiksering. Kredit:A*STAR og W
Fotokemisk nitrogenfiksering – åbner nye udsigter mod en bæredygtig energifremtid(a) En oversigt over N2-kredsløbet og cirkulationen af N2 i forskellige former. (b) Illustration af den avancerede forskning i udviklingen af fotokatalysatorer til N2-fiksering. Kredit:A*STAR og W
- Hvordan sammenligner spektre af sol og grønt blad?
- Kan en 9 volt 1000 M-adapter erstatte 200 adapter- polariteten er af samme- dette bruges ikke som op…
- Hvilken reagens, der adskiller de kemiske egenskaber hos Ag og Mg?
- Hvilken tilstand af stof er repræsenteret af lithosfæren?
- Hvad er den mindst lyseste planet?
- Hvordan laver man en prokaryot cellemodel


