Stabiliteten af den tredimensionelle form Mange store molekyler er afhængige af?
1. Ikke-kovalente interaktioner: Dette er svagere interaktioner, der spiller en afgørende rolle i stabiliseringen af den overordnede form. De inkluderer:
* Hydrogenbindinger: Disse er relativt stærke interaktioner mellem et hydrogenatom kovalent knyttet til et stærkt elektronegativt atom (som ilt eller nitrogen) og et elektronpar på et andet elektronegativt atom. De spiller en vigtig rolle i at opretholde strukturen af proteiner, nukleinsyrer og kulhydrater.
* Hydrofobe interaktioner: Disse interaktioner forekommer mellem ikke -polære molekyler eller dele af molekyler i et vandigt miljø. De har en tendens til at klynge sig sammen og minimere deres kontakt med vand og dermed stabilisere strukturen.
* van der Waals Forces: Disse er svage attraktioner med kort rækkevidde mellem alle molekyler, der stammer fra midlertidige udsving i elektronfordeling. De bidrager til molekylets samlede stabilitet ved at holde atomer tæt sammen.
* ioniske interaktioner: Dette er elektrostatiske interaktioner mellem modsat ladede ioner eller grupper. De er vigtige i foldning og stabilitet af proteiner og andre makromolekyler.
2. Kovalente obligationer: Selvom det ikke er den primære determinant for tredimensionel form, giver kovalente bindinger i molekylet de grundlæggende rammer og definerer de mulige interaktioner, der kan forekomme.
3. Miljøfaktorer:
* Temperatur: Højere temperaturer kan forstyrre ikke-kovalente interaktioner, hvilket fører til udfoldelse eller denaturering af molekylet.
* ph: Miljøets pH kan påvirke ioniseringstilstanden for aminosyrer og andre funktionelle grupper, ændre interaktioner og stabilitet.
* opløsningsmiddel: Tilstedeværelsen af specifikke opløsningsmidler kan påvirke interaktionerne og derfor stabiliteten af molekylet.
4. Molekylstørrelse og kompleksitet: Større og mere komplekse molekyler kræver generelt et større antal og mangfoldighed af interaktioner for at opretholde deres stabile form.
5. Intrinsiske egenskaber: Den iboende fleksibilitet og stivhed af molekylets rygrad og sidekæder bidrager til den samlede stabilitet.
Det er vigtigt at huske, at disse faktorer ofte fungerer sammen for at påvirke den tredimensionelle form af store molekyler. Det specifikke samspil mellem disse kræfter kan variere afhængigt af molekylets struktur og funktion.
 Varme artikler
Varme artikler
-
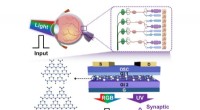 Nethinden-inspirerede carbon nitrid-baserede fotoniske synapser til selektiv registrering af UV-lysEn sammenligning mellem en biologisk nethinde (Top) og en kunstig fotofølsom neuromorf enhed. Kredit:Tae-Woo Lee Forskere ved Seoul National University og Inha University i Sydkorea har udviklet f
Nethinden-inspirerede carbon nitrid-baserede fotoniske synapser til selektiv registrering af UV-lysEn sammenligning mellem en biologisk nethinde (Top) og en kunstig fotofølsom neuromorf enhed. Kredit:Tae-Woo Lee Forskere ved Seoul National University og Inha University i Sydkorea har udviklet f -
 Tæller perovskitterGlasrør med kvanteprikker af perovskit -nanokrystaller, lysende med alle regnbuens farver under ultraviolet stråling. Kredit:Shutterstock Marina Filip, Postdoktoral forskningsassistent, og Felicia
Tæller perovskitterGlasrør med kvanteprikker af perovskit -nanokrystaller, lysende med alle regnbuens farver under ultraviolet stråling. Kredit:Shutterstock Marina Filip, Postdoktoral forskningsassistent, og Felicia -
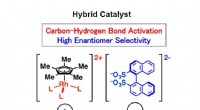 Hybrid katalysator med høj enantiomer selektivitetHybridkatalysatoren er dannet ved at kombinere en enkelt struktureret, kommercielt tilgængeligt rhodium og en let tilgængelig organisk katalysator gennem ioniske interaktioner. Kredit:Hokkaido Univers
Hybrid katalysator med høj enantiomer selektivitetHybridkatalysatoren er dannet ved at kombinere en enkelt struktureret, kommercielt tilgængeligt rhodium og en let tilgængelig organisk katalysator gennem ioniske interaktioner. Kredit:Hokkaido Univers -
 Syntetisk proteinkvalitetskontrolsystem i bakterierKredit:Unsplash/CC0 Public Domain Den 5. februar, Seoul National University, College of Engineering (Dean Kookheon Char) annoncerede, at professor Sang Woo Seos forskergruppe (Dr. Jina Yang og Mr.
Syntetisk proteinkvalitetskontrolsystem i bakterierKredit:Unsplash/CC0 Public Domain Den 5. februar, Seoul National University, College of Engineering (Dean Kookheon Char) annoncerede, at professor Sang Woo Seos forskergruppe (Dr. Jina Yang og Mr.
- Fun Glycerin Experiments
- Tilsætning af organisk stof til jorden har en begrænset effekt på vandholdende kapacitet
- Hvad er livscyklussen i forholdet til måne?
- Nødde og bolt bestående af samme metal foretrækkes hvorfor?
- Eksperter vækker alarm over klimaforandringernes trussel mod kulturarven
- Hvilke former, når vanddamp skifter direkte til is uden at blive en væske først?


