Hvad er de fire kræfter, der virker på aminosyrer placeret i vand?
1. Hydrogenbinding:
* Beskrivelse: Aminosyrer har funktionelle grupper som amin (-NH2) og carboxyl (-COOH) grupper, som kan danne brintbindinger med vandmolekyler. Dette er den primære kraft, der er ansvarlig for opløseligheden af aminosyrer.
2. Elektrostatiske interaktioner (ioniske kræfter):
* Beskrivelse: De ladede grupper i aminosyrer, ligesom amino- og carboxylgrupperne ved terminerne og sidekæderne af nogle aminosyrer (f.eks. Lysin, arginin, glutaminsyre, asparaginsyre), kan interagere med vandmolekyler gennem elektrostatiske interaktioner.
3. Van der Waals Forces:
* Beskrivelse: Dette er svage, korte afstands attraktive kræfter, der forekommer mellem alle molekyler, herunder vand og de ikke-polære dele af aminosyrer. De bidrager til de overordnede interaktioner, men er mindre signifikante end hydrogenbinding eller elektrostatiske kræfter.
4. Hydrofobe interaktioner:
* Beskrivelse: Ikke-polære sidekæder af aminosyrer har en tendens til at klynge sig sammen i vand for at minimere deres kontakt med de polære vandmolekyler. Dette er drevet af den entropiske fordel ved vandmolekyler, der interagerer med hinanden, hvilket er mere gunstigt end at interagere med de hydrofobe sidekæder.
5. Dipole-dipol-interaktioner:
* Beskrivelse: Mens de ofte er grupperet under van der Waals -kræfter, er disse interaktioner forårsaget af de permanente dipoler inden for polære molekyler som vand. Dette er vigtigt, da den polære natur af vandmolekyler er afgørende for at solvere de polære dele af aminosyrer.
Nøglepunkt: Samspillet mellem disse kræfter, især hydrogenbinding, hydrofobe interaktioner og elektrostatiske interaktioner, bestemmer opløselighed, konformation og interaktioner mellem aminosyrer i vandige miljøer.
 Varme artikler
Varme artikler
-
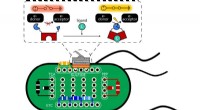 Switch-in-a-celle elektrificerer livetRice University forskere brugte E coli bakterier som en platform til at teste proteinkontakter, der kan bruges til at kontrollere strømmen af elektroner. Proteiner placeret i celler kan simpelthen
Switch-in-a-celle elektrificerer livetRice University forskere brugte E coli bakterier som en platform til at teste proteinkontakter, der kan bruges til at kontrollere strømmen af elektroner. Proteiner placeret i celler kan simpelthen -
 Forskere afslører sensor, der hurtigt opdager COVID-19-infektionNår den er knyttet til understøttende elektronik, sensoren kan trådløst overføre data til brugerens mobiltelefon via Bluetooth. Kredit:Caltech Et træk ved COVID-19-virussen, der gør den så vanskel
Forskere afslører sensor, der hurtigt opdager COVID-19-infektionNår den er knyttet til understøttende elektronik, sensoren kan trådløst overføre data til brugerens mobiltelefon via Bluetooth. Kredit:Caltech Et træk ved COVID-19-virussen, der gør den så vanskel -
 Vedvarende fotokonduktivitet bruges til at stimulere neurotypiske cellerEksponering af GaN for UV-lys forårsager en ophobning af elektroner ved den biologiske grænseflade, selv efter at lyset er fjernet. Dette fænomen, kendt som persistent fotokonduktivitet (PPC), kan bru
Vedvarende fotokonduktivitet bruges til at stimulere neurotypiske cellerEksponering af GaN for UV-lys forårsager en ophobning af elektroner ved den biologiske grænseflade, selv efter at lyset er fjernet. Dette fænomen, kendt som persistent fotokonduktivitet (PPC), kan bru -
 Enkeltkrystallinske kvaternære sulfid -nanobelterKobberbaserede kvaternære sulfid-nanomaterialer, især for Cu-Zn-In-S (CZIS) og Cu-Zn-Ga-S (CZGS), som består af giftfri elementer er attraktive kandidater til solfotokatalytisk brintproduktion på grun
Enkeltkrystallinske kvaternære sulfid -nanobelterKobberbaserede kvaternære sulfid-nanomaterialer, især for Cu-Zn-In-S (CZIS) og Cu-Zn-Ga-S (CZGS), som består af giftfri elementer er attraktive kandidater til solfotokatalytisk brintproduktion på grun
- Flydende del af blod, der indeholder salte og proteiner?
- Burning Corn Vs. Træpiller
- Hvad dræber Minnesota-elge? Forskere igangsætter en ny indsats for at finde ud af det
- Forskellige typer af mikroskoper og deres anvendelser
- Teorier om oprindelsen af de første amerikanske indianer
- Hvad er nøglen, der hjælper med at identificere organismer?


