Hvilke typer molekyler er uopløselige i vand?
1. Ikke -polære molekyler:
* kulbrinter: Kæder eller ringe af kulstof- og hydrogenatomer (f.eks. Methan, propan, olie, fedt). Disse molekyler har meget lille forskel i elektronegativitet mellem deres atomer, hvilket gør dem ikke -polære.
* aromatiske forbindelser: Cykliske kulbrinter med skiftende dobbeltbindinger (f.eks. Benzen, naphthalen).
* Gasser: De fleste gasser som nitrogen, ilt og kuldioxid er ikke -polære og uopløselige i vand.
2. Store molekyler med for det meste ikke -polære grupper:
* voks: Lange kæder af fedtsyrer knyttet til langkædede alkoholer.
* steroider: Komplekse ringstrukturer som kolesterol og hormoner.
* Proteiner: Mens proteiner har polære regioner, kan de også have store ikke -polære sektioner, der gør dem uopløselige i vand.
3. Molekyler med stærke intermolekylære kræfter, der overfører vandets tiltrækning:
* Nogle salte: Mens mange salte opløses i vand, har nogle som sølvchlorid (AgCl) og bariumsulfat (BASO4) meget stærke ioniske bindinger, der forhindrer dem i at opløse.
Nøgleprincipper:
* "som opløser som" :Polære molekyler opløses godt i polære opløsningsmidler som vand, mens ikke -polære molekyler opløses godt i ikke -polære opløsningsmidler som olie.
* Hydrogenbinding: Vands stærke hydrogenbinding gør det til et godt opløsningsmiddel for polære molekyler, der også kan danne hydrogenbindinger.
* Hydrofobe interaktioner: Ikke -polære molekyler har en tendens til at klumpe sammen i vand for at minimere deres kontakt med de polære vandmolekyler, hvilket fører til deres uopløselighed.
Vigtig note: Begrebet "uopløseligt" er relativt. Selv tilsyneladende "uopløselige" stoffer kan opløses i vand i lille grad. Det er mere nøjagtigt at sige, at de er * dårligt opløselige * eller har meget lav opløselighed.
 Varme artikler
Varme artikler
-
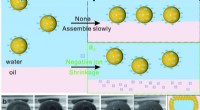 Overfladeforbedret Raman-spektroskopimetode realiserer kvantitativ påvisning af kræftlægemidler i…Figur 1. Skematisk diagram af 3D-hotspot-matrixdannelse. Kredit:Zhou Guoliang Ved at bruge den krympesamlede flydende tredimensionelle (3D) hot spot matrix som en mikroreaktor, blev en ny metode ti
Overfladeforbedret Raman-spektroskopimetode realiserer kvantitativ påvisning af kræftlægemidler i…Figur 1. Skematisk diagram af 3D-hotspot-matrixdannelse. Kredit:Zhou Guoliang Ved at bruge den krympesamlede flydende tredimensionelle (3D) hot spot matrix som en mikroreaktor, blev en ny metode ti -
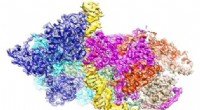 Højopløsningsbillede af strukturen af oprindelsesgenkendelseskomplekset bundet til DNA afsløretSide- (Orc1/2) og bundbillede (WHD) af ORC-DNA-komplekset (72-bp). Kredit:Division of Life Science, Hong Kong University of Science and Technology Celler formerer sig ved at lave kopier af sig sel
Højopløsningsbillede af strukturen af oprindelsesgenkendelseskomplekset bundet til DNA afsløretSide- (Orc1/2) og bundbillede (WHD) af ORC-DNA-komplekset (72-bp). Kredit:Division of Life Science, Hong Kong University of Science and Technology Celler formerer sig ved at lave kopier af sig sel -
 Forskere udvikler unikke materialer til at reparere beskadigede organer og vævForskere skabte biokompatible og bioresorberbare polymermaterialer. Kredit:Peter den Store St. Petersborg Polytekniske Universitet Vævsteknologi er fremtiden for medicin. Polymer Materials for Tis
Forskere udvikler unikke materialer til at reparere beskadigede organer og vævForskere skabte biokompatible og bioresorberbare polymermaterialer. Kredit:Peter den Store St. Petersborg Polytekniske Universitet Vævsteknologi er fremtiden for medicin. Polymer Materials for Tis -
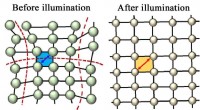 Lys afslapper krystal for at øge solcelleeffektivitetenKonstant belysning blev fundet for at slappe af gitteret af et perovskitlignende materiale, gør det mere effektivt til at opsamle sollys og omdanne det til energi. Det stabile materiale blev testet ti
Lys afslapper krystal for at øge solcelleeffektivitetenKonstant belysning blev fundet for at slappe af gitteret af et perovskitlignende materiale, gør det mere effektivt til at opsamle sollys og omdanne det til energi. Det stabile materiale blev testet ti
- Forureningers indvirkning på historiske monumenter
- Vulkanaskepåvirkning på flyrejser kan reduceres:forskning
- Hvad er nukleotidsekvensen af komplementær streng -DNA -molekyle t c g a c?
- 300 gram er den brøkdel på 1 kg?
- Hvilke elementer er de vigtigste kontituenter i levende organisme?
- Sådan konverteres milliliter til Grams


