Hvilke faktorer bestemmer fasen af et stof ved den givne temperatur?
1. Intermolekylære kræfter:
* styrke af intermolekylære kræfter: Stærkere intermolekylære kræfter, som hydrogenbinding, dipol-dipol-interaktioner og London-spredningskræfter, kræver mere energi til at overvinde. Dette betyder, at stoffer med stærkere intermolekylære kræfter har en tendens til at være i den faste fase ved lavere temperaturer.
* type intermolekylære kræfter: Den specifikke type intermolekylær kraft påvirker strukturen og arrangementet af molekyler, hvilket påvirker faseovergangstemperaturerne. For eksempel fører hydrogenbinding til højere smelte- og kogepunkter sammenlignet med dipol-dipolkræfter.
2. Temperatur:
* kinetisk energi: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Højere temperaturer betyder, at molekyler har mere kinetisk energi, som kan overvinde intermolekylære kræfter og føre til overgange fra fast stof til væske eller væske til gas.
3. Tryk:
* eksternt tryk: Forøget tryk favoriserer generelt tættere faser som faste stoffer og væsker. Dette skyldes, at højere tryk kræfter molekyler tættere sammen.
4. Molekylær struktur og størrelse:
* molekylær kompleksitet: Mere komplekse molekyler med større overfladeareal har en tendens til at have stærkere London -spredningskræfter, hvilket fører til højere smeltnings- og kogepunkter.
* molekylær masse: Tyngre molekyler har typisk stærkere intermolekylære kræfter og dermed højere smelte- og kogepunkter.
5. Andre faktorer:
* urenheder: Tilstedeværelsen af urenheder kan forstyrre det regelmæssige arrangement af molekyler, der påvirker smelte- og kogepunkter.
* allotropes: Forskellige former for det samme element (allotropes) kan have forskellige smeltnings- og kogepunkter på grund af deres forskellige strukturer.
Hvordan disse faktorer fungerer sammen:
* solid fase: Ved lave temperaturer er intermolekylære kræfter stærke nok til at holde molekyler i en fast, stiv struktur.
* flydende fase: Når temperaturen stiger, får molekyler nok kinetisk energi til at bryde fri fra nogle intermolekylære kræfter, så de kan flyde og bevæge sig forbi hinanden.
* gasfase: Ved høje temperaturer har molekyler nok kinetisk energi til at overvinde alle intermolekylære kræfter og bevæge sig frit, hvilket besætter hele det tilgængelige volumen.
Kortfattet:
Fasen af et stof ved en given temperatur er et komplekst samspil af faktorer. At forstå disse faktorer hjælper med at forudsige og forklare overgange mellem faste, flydende og gasformige faser.
Sidste artikelHvad er produkterne fra fototsyntese?
Næste artikelEt molekyle reduceres, når det?
 Varme artikler
Varme artikler
-
 Kemikere udvikler forskellige industrielt vigtige syntetiske processerProf. Dr. David Scheschkewitz Kredit:Saarland University/Oliver Dietze Dannelsen af dobbeltbindinger mellem to carbonatomer (C =C) er af central betydning i naturlige organismer. Langt de fleste
Kemikere udvikler forskellige industrielt vigtige syntetiske processerProf. Dr. David Scheschkewitz Kredit:Saarland University/Oliver Dietze Dannelsen af dobbeltbindinger mellem to carbonatomer (C =C) er af central betydning i naturlige organismer. Langt de fleste -
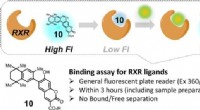 Syntetisk forbindelse giver hurtig screening for potentielle lægemidlerFluorescensen fra forbindelse 10 stiger, når en RXR-målretningsligand fortrænger den, hvilket gør det til en nyttig indikator for ligandaktivitet i assays. Kredit:Okayama University En simpel anal
Syntetisk forbindelse giver hurtig screening for potentielle lægemidlerFluorescensen fra forbindelse 10 stiger, når en RXR-målretningsligand fortrænger den, hvilket gør det til en nyttig indikator for ligandaktivitet i assays. Kredit:Okayama University En simpel anal -
 Styring af termisk ledningsevne af polymerer med lysUnder omgivelsesbetingelser eller synligt lys (venstre side), polymeren er krystallinsk og har en høj varmeledningsevne. Når den er udsat for ultraviolet (UV) lys (højre side), omdannes den til en væs
Styring af termisk ledningsevne af polymerer med lysUnder omgivelsesbetingelser eller synligt lys (venstre side), polymeren er krystallinsk og har en høj varmeledningsevne. Når den er udsat for ultraviolet (UV) lys (højre side), omdannes den til en væs -
 Nedbrydningsstatus for moderne polymere museumsartefakter kan klassificeres efter deres lugtKredit:Wiley Åndedrætsanalyse i sygdomsdiagnostik er et lovende forskningsfelt, og fremskridtene inden for instrumentering muliggør nøjagtig påvisning af metabolitter. Men ikke kun patienternes he
Nedbrydningsstatus for moderne polymere museumsartefakter kan klassificeres efter deres lugtKredit:Wiley Åndedrætsanalyse i sygdomsdiagnostik er et lovende forskningsfelt, og fremskridtene inden for instrumentering muliggør nøjagtig påvisning af metabolitter. Men ikke kun patienternes he
- Hvornår kunne et lille objekt have det samme momentum som stort objekt?
- Hvilke skoler i Kentucky tilbyder marinbiologi?
- Massefremstilling af engangsansigtsskærme til Covid-19-respons
- Hvilken farvestjerne har den højeste overfladetemperatur?
- Sentinel moderniserer Europas landbrugspolitik
- Hvor meget energi overføres fra det ene trofiske niveau til det næste?


