Hvilke fremskynder kemiske reaktioner?
1. Temperatur:
* Højere temperatur betyder mere kinetisk energi. Molekyler bevæger sig hurtigere og kolliderer hyppigere, hvilket øger chancen for vellykkede kollisioner, der fører til reaktioner.
2. Koncentration:
* Højere koncentration betyder flere reaktantmolekyler pakket sammen. Dette øger chancerne for kollisioner og derfor reaktionshastigheden.
3. Overfladeareal:
* et større overfladeareal giver mulighed for flere kontaktpunkter mellem reaktanter. Tænk på en fast reaktant - at bryde den i mindre stykker øger overfladearealet, der er udsat for de andre reaktanter, hvilket fremskynder reaktionen.
4. Katalysatorer:
* katalysatorer er stoffer, der fremskynder reaktioner uden at blive fortæret sig selv. De giver en alternativ reaktionsvej med en lavere aktiveringsenergi, der gør det muligt for reaktionen at fortsætte hurtigere.
5. Tryk (for gasformige reaktioner):
* Højere tryk i en gasformig reaktion kræfter molekyler tættere sammen. Dette øger chancerne for kollisioner og fremskynder dermed reaktionen.
6. Omrøring eller agitation:
* omrøring eller agiterende reaktanter hjælper med at blande dem grundigt og øger chancen for kollisioner. Dette er især vigtigt i heterogene reaktioner (reaktioner, der involverer stoffer i forskellige faser).
7. Lys (til fotokemiske reaktioner):
* lys kan give den energi, der er nødvendig for at bryde bindinger og indlede nogle reaktioner. Dette gælder især for fotokemiske reaktioner.
Det er vigtigt at bemærke, at disse faktorer kan arbejde sammen for at påvirke reaktionshastighederne. For eksempel vil øge temperaturen og koncentrationen af reaktanter have en meget større indflydelse på reaktionshastigheden end blot at øge en faktor alene.
 Varme artikler
Varme artikler
-
 Spinout søger at omdanne test af fødevaresikkerhedJanus-emulsionsdråber fanges i færd med at ændre form som reaktion på tilstedeværelsen af forurening med et fødevarepatogen i et laboratoriemiljø. Emulsionerne kan ses med det blotte øje og, ved hjæ
Spinout søger at omdanne test af fødevaresikkerhedJanus-emulsionsdråber fanges i færd med at ændre form som reaktion på tilstedeværelsen af forurening med et fødevarepatogen i et laboratoriemiljø. Emulsionerne kan ses med det blotte øje og, ved hjæ -
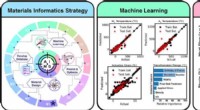 Ny formhukommelseslegering opdaget gennem kunstig intelligens-rammeGrafisk abstrakt. Kredit:Acta Materialia (2022). DOI:10.1016/j.actamat.2022.117751 Forskere fra Department of Materials Science and Engineering ved Texas A&M University har brugt en Artificial Inte
Ny formhukommelseslegering opdaget gennem kunstig intelligens-rammeGrafisk abstrakt. Kredit:Acta Materialia (2022). DOI:10.1016/j.actamat.2022.117751 Forskere fra Department of Materials Science and Engineering ved Texas A&M University har brugt en Artificial Inte -
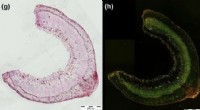 Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad
Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad -
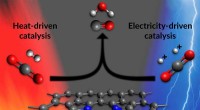 Hvordan en enkelt katalysator kan begynde at omdanne kuldioxid til brændstof på to måderDenne illustration viser et af de aktive steder i en ny katalysator, der fremskynder det første trin i fremstilling af brændstoffer og nyttige kemikalier fra kuldioxid. De aktive steder består af nikk
Hvordan en enkelt katalysator kan begynde at omdanne kuldioxid til brændstof på to måderDenne illustration viser et af de aktive steder i en ny katalysator, der fremskynder det første trin i fremstilling af brændstoffer og nyttige kemikalier fra kuldioxid. De aktive steder består af nikk
- Hvad er affaldet ved produkter fra brintbrændselsceller?
- Hvad er miljøpåvirkning?
- Er hydrolyse syntesen af kæmpe molekyler fra komponenter, der gentager enheder?
- Månens guldfeber er ved at starte - og vi kan udmatte solsystemet på mindre end 500 år
- Hvad er der på 0 grader Celsius?
- Hvilken er længere 350 mm eller 0,49 m?


