Hvad er tre typer kemiske bindinger, der indeholder atomer og molekyler sammen?
1. ioniske bindinger: Disse bindinger dannes, når et atom (den mere elektronegative) helt tager et elektron fra et andet atom. Dette skaber modsat ladede ioner (kationer og anioner), der tiltrækker hinanden gennem elektrostatiske kræfter. Dette resulterer i en stærk bånd. Eksempler inkluderer NaCl (tabel salt) og CaCl2 (calciumchlorid).
2. kovalente obligationer: Disse bindinger dannes, når atomer deler elektroner. Denne deling kan være ens (ikke -polær kovalent binding) eller ulig (polær kovalent binding) afhængigt af elektronegativitetsforskellen mellem atomerne. Disse bindinger er typisk stærkere end ioniske bindinger. Eksempler inkluderer H2 (brintgas) og H2O (vand).
3. Metalliske obligationer: Disse bindinger forekommer i metaller, hvor valenselektronerne delokaliseres og bevæger sig frit gennem hele metalgitteret. De positive metalioner holdes sammen af et hav af disse mobile elektroner. Dette resulterer i en stærk binding og forklarer mange af metallers egenskaber, såsom deres høje ledningsevne og formbarhed. Et eksempel er kobber (Cu).
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse obligationstyper!
Sidste artikelHvad er genoptagelse og enzymnedbrydning?
Næste artikelHvilken reaktion katalyserer enzymperoxidase?
 Varme artikler
Varme artikler
-
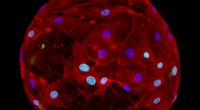 Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom
Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom -
 En mere kortfattet måde at syntetisere tetrodotoxin påKredit:Unsplash/CC0 Public Domain Et lille internationalt team af forskere har udviklet en måde at syntetisere tetrodotoxin (TTX) ved at bruge langt færre trin end tidligere metoder. I deres papir
En mere kortfattet måde at syntetisere tetrodotoxin påKredit:Unsplash/CC0 Public Domain Et lille internationalt team af forskere har udviklet en måde at syntetisere tetrodotoxin (TTX) ved at bruge langt færre trin end tidligere metoder. I deres papir -
 Kirigami kan dreje terahertz -stråler i realtid for at kigge ind i biologisk vævAtelier Kirigami/Origami. Cristian Bortes, CC BY 2.0. Med en letspinningsanordning inspireret af den japanske kunst at skære papir, University of Michigan forskere har fundet mikroskopiske vending
Kirigami kan dreje terahertz -stråler i realtid for at kigge ind i biologisk vævAtelier Kirigami/Origami. Cristian Bortes, CC BY 2.0. Med en letspinningsanordning inspireret af den japanske kunst at skære papir, University of Michigan forskere har fundet mikroskopiske vending -
 Modellering af en bedre katalysator for PIBSA'erKredit:Pixabay/CC0 Public Domain Polyisobutenylravsyreanhydrider (PIBSAer) er vigtige for bilindustrien på grund af deres brede anvendelse i smøremidler og brændstofformuleringer. Deres syntese, i
Modellering af en bedre katalysator for PIBSA'erKredit:Pixabay/CC0 Public Domain Polyisobutenylravsyreanhydrider (PIBSAer) er vigtige for bilindustrien på grund af deres brede anvendelse i smøremidler og brændstofformuleringer. Deres syntese, i


