4 Hvad sker der, når du øger overfladearealet af reaktanter i en reaktion?
* flere kontaktpunkter: Når du øger overfladearealet, skaber du flere punkter, hvor reaktanterne kan komme i kontakt med hinanden. Dette gør det muligt at forekomme flere kollisioner mellem reaktantmolekylerne.
* øget hyppighed af kollisioner: Flere kollisioner betyder en større sandsynlighed for, at molekylerne vil kollidere med nok energi til at overvinde aktiveringsenergibarriere og formprodukter.
* hurtigere reaktionshastighed: Den samlede effekt er, at reaktionen fortsætter hurtigere.
Eksempler:
* brændende træ: En bunke med træflis brænder hurtigere end en enkelt bjælke, fordi chipsene har et meget større overfladeareal udsat for luften.
* opløste sukker: Sukkerterninger tager længere tid at opløses i vand end granuleret sukker, fordi terningerne har mindre overfladeareal udsat.
* katalysatorer: Katalysatorer fungerer ved at tilvejebringe en overflade med et højt overfladeareal for reaktanter til at interagere, hvilket fremskynder reaktionen.
Undtagelser:
Der er situationer, hvor stigende overfladeareal muligvis ikke øger reaktionshastigheden eller endda reducerer den. Dette kan forekomme, hvis:
* Reaktionen er allerede meget hurtig.
* Reaktionen er begrænset af andre faktorer, såsom tilgængeligheden af en reaktant i opløsning.
* Det øgede overfladeareal fører til uønskede bivirkninger.
Generelt er det en almindelig strategi for at fremskynde kemiske reaktioner at øge overfladearealet for reaktanter.
 Varme artikler
Varme artikler
-
 Video:Glaspusteriets kunst og videnskabKredit:The American Chemical Society Hvis du nogensinde har trykket på en skærm for at sende et tweet, valgt en sodavand på glasflaske på grund af smag, eller savlede over kunstglas i et galleri,
Video:Glaspusteriets kunst og videnskabKredit:The American Chemical Society Hvis du nogensinde har trykket på en skærm for at sende et tweet, valgt en sodavand på glasflaske på grund af smag, eller savlede over kunstglas i et galleri, -
 Formskiftende materiale kan forvandles, vende sig selv ved hjælp af varme, lysKredit:University of Colorado at Boulder Et nyt materiale udviklet af University of Colorado Boulders ingeniører kan forvandle sig til komplekse, forprogrammerede former via lys- og temperaturstim
Formskiftende materiale kan forvandles, vende sig selv ved hjælp af varme, lysKredit:University of Colorado at Boulder Et nyt materiale udviklet af University of Colorado Boulders ingeniører kan forvandle sig til komplekse, forprogrammerede former via lys- og temperaturstim -
 Vandoverfladen er et fantastisk sted for kemiske reaktionerKredit:Pixabay/CC0 Public Domain Ved at bruge en avanceret teknik, forskere fra RIKEN-klyngen for banebrydende forskning har påvist, at en kemisk reaktion drevet af lys finder sted ti tusinde gang
Vandoverfladen er et fantastisk sted for kemiske reaktionerKredit:Pixabay/CC0 Public Domain Ved at bruge en avanceret teknik, forskere fra RIKEN-klyngen for banebrydende forskning har påvist, at en kemisk reaktion drevet af lys finder sted ti tusinde gang -
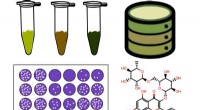 Et stof, der findes i brunkul, kan hjælpe med at bekæmpe viraAntiviral aktivitet af ti humusstofprøver (HS) blev vurderet mod flåtbåren encephalitisvirus reproduktion. For at afsløre mulige aktive komponenter i HS -prøver blev der søgt efter FTICR MS -data i Ch
Et stof, der findes i brunkul, kan hjælpe med at bekæmpe viraAntiviral aktivitet af ti humusstofprøver (HS) blev vurderet mod flåtbåren encephalitisvirus reproduktion. For at afsløre mulige aktive komponenter i HS -prøver blev der søgt efter FTICR MS -data i Ch
- Bør købe et kikkert eller teleskop til stjerne, der stirrer på en, der bare er himmelelsker og ik…
- hvordan ændres diameteren af hver krusning, som tiden går?
- Hvad er en naturhavn, og hvordan påvirker den miljøet?
- Hvad er den mest forurenende energikilde?
- Hvad er Higgs Boson God Particle?
- Laserstråleexcitation påvirker ikke nukleofil substitutionsreaktion


