Hvad er forskellen mellem et polært molekyle og ikke-polært molekyle?
polære molekyler:
* ujævn fordeling af ladning: Polære molekyler har en ujævn fordeling af elektroner, hvilket skaber en lidt positiv ende (δ+) og en lidt negativ ende (Δ-). Dette skyldes forskelle i elektronegativitet mellem atomerne i molekylet. Elektronegativitet er et atoms evne til at tiltrække elektroner mod sig selv.
* dipolmoment: Polære molekyler har et permanent dipolmoment, som er et mål for adskillelse af ladning inden for molekylet.
* opløselighed: Polære molekyler er generelt opløselige i polære opløsningsmidler som vand. Dette skyldes, at de kan danne brintbindinger med vandmolekylerne.
* Eksempler: Vand (H₂O), ammoniak (NH₃), ethanol (Ch₃ch₂oh)
Ikke-polære molekyler:
* Even Distribution of Charge: Ikke-polære molekyler har en jævn fordeling af elektroner, hvilket betyder, at der ikke er nogen signifikant forskel på grund mellem nogen del af molekylet.
* Intet dipolmoment: Ikke-polære molekyler har ikke et permanent dipolmoment.
* opløselighed: Ikke-polære molekyler er generelt opløselige i ikke-polære opløsningsmidler som olie. De blandes ikke let med polære opløsningsmidler.
* Eksempler: Methan (CH₄), kuldioxid (co₂), hexan (c₆h₁₄)
i enklere termer:
Forestil dig en trækkraft mellem to hold med forskellige styrker. I et polært molekyle er et atom stærkere (mere elektronegativ) og trækker elektronerne tættere på det og skaber en lille negativ ladning på den side. Det svagere atom har en let positiv ladning. I et ikke-polært molekyle har atomerne lignende styrker, så elektronerne er jævnt fordelt.
Her er en tabel, der opsummerer de vigtigste forskelle:
| Funktion | Polært molekyle | Ikke-polært molekyle |
| --- | --- | --- |
| Chargefordeling | Ujævn | Selv |
| Dipolmoment | Permanent | Ingen permanent dipol |
| Opløselighed | Opløselig i polære opløsningsmidler | Opløselig i ikke-polære opløsningsmidler |
| Eksempler | Vand (H₂O), ammoniak (NH₃), ethanol (Ch₃ch₂oh) | Methan (ch₄), kuldioxid (co₂), hexan (c₆h₁₄) |
 Varme artikler
Varme artikler
-
 Vandretøjsstof har en kølende effekt, der kan gøre dit næste smartwatch mere behageligtForskere har opdaget, at et kommercielt stof, der typisk bruges til vandreudstyr, har de varmeledende egenskaber af rustfrit stål, giver materialet mulighed for at aflede varme mere effektivt end andr
Vandretøjsstof har en kølende effekt, der kan gøre dit næste smartwatch mere behageligtForskere har opdaget, at et kommercielt stof, der typisk bruges til vandreudstyr, har de varmeledende egenskaber af rustfrit stål, giver materialet mulighed for at aflede varme mere effektivt end andr -
 Forskere udvikler en måde at bedre forudsige korrosion fra råolieKredit:iStockphoto.com Ved hjælp af røntgenteknikker, forskere udvikler et analyseværktøj, der mere præcist kan forudsige, hvordan svovlforbindelser i et parti råolie kan tære udstyr - et vigtigt
Forskere udvikler en måde at bedre forudsige korrosion fra råolieKredit:iStockphoto.com Ved hjælp af røntgenteknikker, forskere udvikler et analyseværktøj, der mere præcist kan forudsige, hvordan svovlforbindelser i et parti råolie kan tære udstyr - et vigtigt -
 Håndholdt spektralanalysator gør smartphonen til et diagnostisk værktøjDen spektrale transmissions-reflektans-intensitet (TRI) -analysator fastgøres til en smartphone og analyserer patientblod, urin, eller spytprøver lige så pålideligt som klinikbaserede instrumenter, de
Håndholdt spektralanalysator gør smartphonen til et diagnostisk værktøjDen spektrale transmissions-reflektans-intensitet (TRI) -analysator fastgøres til en smartphone og analyserer patientblod, urin, eller spytprøver lige så pålideligt som klinikbaserede instrumenter, de -
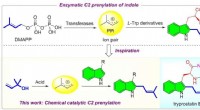 Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den
Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den


