Forskere leverer bevis hos mennesker for RNA-interferens ved hjælp af målrettede nanopartikler
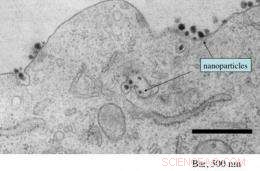
Dette elektronmikrografi viser tilstedeværelsen af talrige siRNA-holdige målrettede nanopartikler, der både kommer ind i og i en tumorcelle. Kredit:Caltech/Swaroop Mishra
Et team af forskere og klinikere ledet af California Institute of Technology (Caltech) har offentliggjort det første bevis på, at en målrettet nanopartikel - brugt som et eksperimentelt terapeutisk middel og injiceret direkte i en patients blodbane - kan handle ind i tumorer, levere dobbeltstrengede små interfererende RNA'er (siRNA'er), og slukke for et vigtigt kræftgen ved hjælp af en mekanisme kendt som RNA-interferens (RNAi). I øvrigt, holdet leverede den første demonstration af, at denne nye type terapi, infunderes i blodbanen, kan finde vej til humane tumorer på en dosisafhængig måde - dvs. et højere antal nanopartikler sendt ind i kroppen fører til et højere antal nanopartikler i tumorcellerne.
Disse resultater, offentliggjort i den 21. marts forhåndsonlineudgave af tidsskriftet Natur , demonstrere gennemførligheden af at bruge både nanopartikler og RNAi-baserede terapier hos patienter, og åbne døren for fremtidige "spilskiftende" terapier, der angriber kræft og andre sygdomme på det genetiske niveau, siger Mark Davis, Warren og Katharine Schlinger professor i kemiteknik ved Caltech, og forskningsteamets leder.
Opdagelsen af RNA-interferens, mekanismen, hvorved dobbeltstrenge af RNA dæmper gener, vandt forskerne Andrew Fire og Craig Mello Nobelprisen i fysiologi eller medicin i 2006. Forskerne rapporterede først, at de fandt denne nye mekanisme i orme i 1998 Natur papir. Siden da, potentialet for, at denne type genhæmning kan føre til nye behandlingsformer for sygdomme som kræft, er blevet meget udråbt.
"RNAi er en ny måde at stoppe produktionen af proteiner på, " siger Davis. Hvad gør det til et potentielt stærkt værktøj, tilføjer han, er det faktum, at dets mål ikke er et protein. De sårbare områder af et protein kan være skjult i dets tredimensionelle folder, gør det svært for mange terapeuter at nå dem. I modsætning, RNA-interferens retter sig mod det messenger-RNA (mRNA), der koder for den information, der er nødvendig for at lave et protein i første omgang.
"I princippet, " siger Davis, "det betyder, at hvert protein nu kan medicineres, fordi dets hæmning opnås ved at ødelægge mRNA'et. Og vi kan gå efter mRNA'er på en meget designet måde givet alle de genomiske data, der er og vil blive tilgængelige."
Stadig, der har været adskillige potentielle vejspærringer for anvendelsen af RNAi-teknologi som terapi hos mennesker. En af de mest problematiske har været at finde en måde at transportere terapien på, som består af skrøbelige siRNA'er, ind i tumorceller efter direkte injektion i blodbanen. Davis, imidlertid, havde en løsning. Selv før opdagelsen af RNAi, han og hans team var begyndt at arbejde på måder at levere nukleinsyrer ind i celler via systemisk administration. De skabte til sidst et fire-komponent system - med en unik polymer - der kan samles selv til en målrettet, siRNA-holdig nanopartikel. SiRNA-leveringssystemet er under klinisk udvikling af Calando Pharmaceuticals, Inc., en Pasadena-baseret nanobiotekvirksomhed.
"Disse nanopartikler er i stand til at tage siRNA'erne til det målrettede sted i kroppen, " siger Davis. Når de når deres mål - i dette tilfælde, kræftcellerne i tumorer - nanopartiklerne trænger ind i cellerne og frigiver siRNA'erne.
De videnskabelige resultater beskrevet i Natur papir er fra et fase I klinisk forsøg med disse nanopartikler, der begyndte at behandle patienter i maj 2008. Fase I forsøg er, Per definition, sikkerhedsforsøg; ideen er at se, om og på hvilket niveau stoffet eller anden behandling bliver skadelig eller giftig. Disse forsøg kan også give et i-menneskeligt videnskabeligt bevis på konceptet - hvilket er præcis, hvad der bliver rapporteret i Nature-papiret.
Denne målrettede nanopartikel, der blev brugt i undersøgelsen og vist i dette skema, er lavet af en unik polymer og kan finde vej til humane tumorceller på en dosisafhængig måde. Kredit:Caltech/Derek Bartlett
Ved at bruge en ny teknik udviklet hos Caltech, holdet var i stand til at detektere og afbilde nanopartikler inde i celler biopsieret fra tumorerne fra flere af forsøgets deltagere. Ud over, Davis og hans kolleger var i stand til at vise, at jo højere nanopartikeldosis, der blev administreret til patienten, jo højere antallet af partikler, der findes inde i tumorcellerne - det første eksempel på denne form for dosisafhængig respons ved hjælp af målrettede nanopartikler.
Endnu bedre, Davis siger, beviserne viste, at siRNA'erne havde gjort deres arbejde. I tumorcellerne analyseret af forskerne, mRNA'et, der koder for cellevækstproteinet ribonukleotidreduktase, var blevet nedbrudt. Denne nedbrydning, på tur, førte til tab af proteinet.
Mere til sagen, de fundne mRNA-fragmenter var nøjagtig den længde og sekvens, de skulle have, hvis de var blevet spaltet på det sted, som siRNA'et målrettede, bemærker Davis. "Det er første gang, nogen har fundet et RNA-fragment fra en patients celler, der viser, at mRNA'et blev skåret på præcis den rigtige base via RNAi-mekanismen, " siger han. "Det beviser, at RNAi-mekanismen kan ske ved hjælp af siRNA i et menneske."
"Der er mange kræftmål, der effektivt kan blokeres i laboratoriet ved hjælp af siRNA, men at blokere dem i klinikken har været undvigende, " siger Antoni Ribas, lektor i medicin og kirurgi ved UCLAs Jonsson Comprehensive Cancer Center. "Dette skyldes, at mange af disse mål ikke kan blokeres af traditionelt designede kræftlægemidler. Denne forskning giver det første bevis på, at det, der virker i laboratoriet, kan hjælpe patienter i fremtiden ved den specifikke levering af siRNA ved hjælp af målrettede nanopartikler. Vi kan begynde at tænke på at målrette det umålrettelige."
"Selvom disse data er meget tidlige, og der er behov for mere forskning, dette er en lovende undersøgelse af et nyt kræftmiddel, og vi er stolte af vores bidrag til den indledende kliniske udvikling af siRNA til behandling af cancer, " siger Anthony Tolcher, direktør for klinisk forskning ved South Texas Accelerated Research Therapeutics (START).
"Lovende data fra de kliniske forsøg validerer vores årelange forskning i City of Hope i ribonukleotidreduktase som et mål for nye genbaserede terapier mod cancer, " tilføjer medforfatter Yun Yen, associeret direktør for translationel forskning hos City of Hope. "Vi ser for første gang nytten af siRNA som kræftterapi, og hvordan nanoteknologi kan målrette mod kræftceller specifikt."
Fase I forsøget – sponsoreret af Calando Pharmaceuticals – fortsætter på START og UCLAs Jonsson Comprehensive Cancer Center, og de kliniske resultater af forsøget vil blive præsenteret på et senere tidspunkt. "I det mindste, vi har bevist, at RNAi-mekanismen kan bruges i mennesker til terapi, og at den målrettede levering af siRNA giver mulighed for systemisk administration, " siger Davis. "Det er en meget spændende tid."
 Varme artikler
Varme artikler
-
 Træer bliver højteknologiske:Processen gør cellulose til energilagringsenhederForskere har opdaget en ny måde at omdanne cellulose til nanoporøse kulstofmembraner i et enkelt trin. Kredit:(grafisk udlånt af Oregon State University) Baseret på en grundlæggende kemisk opdagel
Træer bliver højteknologiske:Processen gør cellulose til energilagringsenhederForskere har opdaget en ny måde at omdanne cellulose til nanoporøse kulstofmembraner i et enkelt trin. Kredit:(grafisk udlånt af Oregon State University) Baseret på en grundlæggende kemisk opdagel -
 En selvdrevet hjertemonitor tapet til hudenKredit:CC0 Public Domain Forskere har udviklet et menneskevenligt, ultra-fleksibel organisk sensor drevet af sollys, som fungerer som en selvdrevet hjerteovervågning. Tidligere har de udviklede en
En selvdrevet hjertemonitor tapet til hudenKredit:CC0 Public Domain Forskere har udviklet et menneskevenligt, ultra-fleksibel organisk sensor drevet af sollys, som fungerer som en selvdrevet hjerteovervågning. Tidligere har de udviklede en -
 At mestre kunsten at bygge nanoskala for at trække vejret let og buste svindelEn demonstration af optiske effekter gjorde det muligt at bruge nanoskala samlingsmetoden til at justere guld nanorods i et materiale. Forskellige farver bliver synlige for observatøren, efterhånden s
At mestre kunsten at bygge nanoskala for at trække vejret let og buste svindelEn demonstration af optiske effekter gjorde det muligt at bruge nanoskala samlingsmetoden til at justere guld nanorods i et materiale. Forskellige farver bliver synlige for observatøren, efterhånden s -
 Ny genvej muliggør hurtigere oprettelse af spin-mønster i magnetKredit:CC0 Public Domain Fysikere har opdaget en meget hurtigere tilgang til at skabe et mønster af spins i en magnet. Denne genvej åbner et nyt kapitel i topologiforskning. Denne opdagelse tilbyd
Ny genvej muliggør hurtigere oprettelse af spin-mønster i magnetKredit:CC0 Public Domain Fysikere har opdaget en meget hurtigere tilgang til at skabe et mønster af spins i en magnet. Denne genvej åbner et nyt kapitel i topologiforskning. Denne opdagelse tilbyd
- Tidoblet stigning i nedskæringer i CO2-emissioner, der er nødvendige for at dæmme op for klimakri…
- NASA leverer en infrarød analyse af Tropical Storm Fengshen
- Aldrende befolkninger vil trække væksten i Asien i langdrag:IMF-chef
- Forskere undersøger radiomærkning af calciumcarbonatpartikler in vivo
- Røg i ild kan bære mikrober, der forårsager infektionssygdomme
- Billede:Klargøring af Parker Solar Probe til rummet


