Agn på størrelse med molekyler brugt af forskere til at fiske efter nye lægemiddelmål
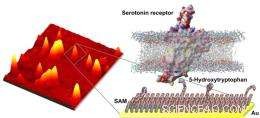
Fiskeri efter molekyler. (Venstre) Atomic force mikroskopi billede af serotonin precursor-modificeret overflade med indfangede serotonin receptor-holdige nanovesikler. (Til højre) Illustration af overfladekemiens molekylære strukturer og de relative størrelsesforskelle mellem "lokkemad" (5-hydroxytryptophan) og de membranassocierede serotoninreceptorer, der selektivt fanges af disse overflader.
(PhysOrg.com) -- Den nye teknik, hvor molekyler bruges som lokkemad til at fange og studere store biomolekyler, kan føre til en ny generation af psykiatrisk medicin.
UCLA-forskere og deres samarbejdspartnere har udviklet en metode, der kan åbne døren for undersøgelser af funktionen af halvdelen af alle proteiner i menneskekroppen.
Forskerholdet har demonstreret kontrol i nanoskala over molekyler, giver mulighed for den præcise undersøgelse af interaktioner mellem proteiner og små molekyler. Deres nye teknik, hvor molekyler bruges som lokkemad til at fange og studere store biomolekyler, kan føre til en ny generation af psykiatrisk medicin.
I et papir offentliggjort sidste måned i tidsskriftet ACS Chemical Neuroscience , et tværfagligt team af forskere fra UCLA og Pennsylvania State University (PSU) rapporterer om deres undersøgelse af interaktionerne mellem store biomolekyler, som omfatter DNA og proteiner, og små molekyler, som omfatter hormoner og neurotransmittere såsom serotonin.
Forskerholdet, ledet af Anne Andrews, professor i psykiatri og forsker ved både Semel Institute for Neuroscience and Human Behavior ved UCLA og UCLAs California NanoSystems Institute (CNSI), studerer disse interaktioner for at identificere en ny generation af mål, eller nøglemolekyler, der svarer til specifikke sygdomme eller tilstande.
Interaktioner mellem store biomolekyler og små molekyler er allestedsnærværende i naturen; de er metoden til kommunikation inden for og mellem celler. Men disse interaktioner har vist sig at være svære at isolere i et laboratoriemiljø. Øget forståelse af disse interaktioner er afgørende for udviklingen af ny medicin til psykiatriske lidelser, siger forskerne.
"I øjeblikket, man ved kun lidt om, hvilke mål der gælder for specifikke sygdomme, " sagde Andrews. "Farmaceutiske virksomheder er meget gode til at designe medicin, når de først har et mål at gå efter; min gruppe arbejder på at give dem mål."
Indtil dette punkt, lægemiddeludvikling til psykiatriske lidelser såsom depression har været en trial-and-error-proces, hvor medicinalvirksomheder raffinerer nye lægemidler baseret på nogle få eksisterende lægemidler, der blev opdaget ved et uheld. Andrews sagde, at hun håber, at hendes teams forskning vil føre til mere effektive behandlinger, fordi nuværende depressionsmedicin kun virker for 30 til 50 procent af befolkningen.
Kontrol i nanoskala er nøglen til UCLA-Penn State-holdets resultater. Deres gennembrud udnytter arbejdet fra medforfatteren Paul Weiss' forskningsgruppe om mønstre af selvsamlede monolag (SAM'er), enkelte lag af molekyler, der orienterer sig på flade overflader. Weiss, en fremtrædende professor i kemi og biokemi, der har UCLA's Fred Kavli Chair i Nanosystems Sciences, og andre opdagede, at SAM'er faktisk ikke danner perfekte overflader. De indeholder defekter, som igen kan bruges til at isolere enkelte molekyler.
"I øjeblikket er vi i stand til at placere defekter ud over en overflade. Vi bruger derefter disse defekter til at kontrollere placeringen og miljøet af de enkelte funktionelle molekyler, " sagde Weiss, som også er direktør for CNSI.
Selv afstand er vigtigt, fordi UCLA-Penn State-holdet placerede serotonin, et lille molekyle, i defekter til at fungere som lokkemad til at fange og studere store molekyler. Hvis fejlene ikke er meget spredte, der er ikke nok plads mellem serotoninmolekyler til at hver enkelt kan fange et stort molekyle.
Interaktioner mellem store biomolekyler og små molekyler har vist sig notorisk vanskelige at studere ved hjælp af tidligere metoder. Når SAM-fiskestangen, der er lokket med serotonin, fanger et stort molekyle, forskerholdet er i stand til at studere interaktionerne på en måde, der replikerer molekylernes naturlige interaktioner.
 Varme artikler
Varme artikler
-
 Opdagelse kan hjælpe med at opdage atomtruslerLektorer Swastik Kar, venstre, og Yung Joon Jung, ret, har samarbejdet om forskning relateret til carbon nanorør i mere end 10 år. Kredit:Mary Knox Merrill/Northeastern University National sikkerh
Opdagelse kan hjælpe med at opdage atomtruslerLektorer Swastik Kar, venstre, og Yung Joon Jung, ret, har samarbejdet om forskning relateret til carbon nanorør i mere end 10 år. Kredit:Mary Knox Merrill/Northeastern University National sikkerh -
 Cool tekstiler til at slå varmenForskere har udviklet en 3D-printbar fiber til tøj, der kan køle dig ned. Kredit:American Chemical Society Bygninger med aircondition bringer velkommen lettelse til folk, der kommer ind fra varmen
Cool tekstiler til at slå varmenForskere har udviklet en 3D-printbar fiber til tøj, der kan køle dig ned. Kredit:American Chemical Society Bygninger med aircondition bringer velkommen lettelse til folk, der kommer ind fra varmen -
 Fra super- til ultraopløselig mikroskopi:Ny metode skubber grænsen til billedopløsningBilledet viser, hvordan teknologien Discrete Molecular Imaging (DMI) visualiserer tæt pakket individuelle mål, der kun er 5 nanometer fra hinanden i DNA origami -strukturer (se skemaer til venstre). B
Fra super- til ultraopløselig mikroskopi:Ny metode skubber grænsen til billedopløsningBilledet viser, hvordan teknologien Discrete Molecular Imaging (DMI) visualiserer tæt pakket individuelle mål, der kun er 5 nanometer fra hinanden i DNA origami -strukturer (se skemaer til venstre). B -
 Forskning efterligner hjerneceller for at øge hukommelseskraftenDr Sharath Sriram, RMIT Universitet RMIT University forskere har bragt ultrahurtige, nano-skala datalagring inden for slående rækkevidde, ved hjælp af teknologi, der efterligner den menneskelige h
Forskning efterligner hjerneceller for at øge hukommelseskraftenDr Sharath Sriram, RMIT Universitet RMIT University forskere har bragt ultrahurtige, nano-skala datalagring inden for slående rækkevidde, ved hjælp af teknologi, der efterligner den menneskelige h
- Routergæstnetværk mangler tilstrækkelig sikkerhed, ifølge forskere
- Rusland mister kontakten med angolansk satellit (opdatering)
- Video:Brug guldsmede til at måle kviksølvforurening
- Hvordan påvirker fosfater vandkvaliteten?
- Ny slags solceller kunne fange betydeligt mere energi end nuværende celler
- Forklarer:Sådan fungerer Googles søgeresultater


