Forskere kombinerer svage kemiske kræfter for at styrke ny billeddannelsesteknologi
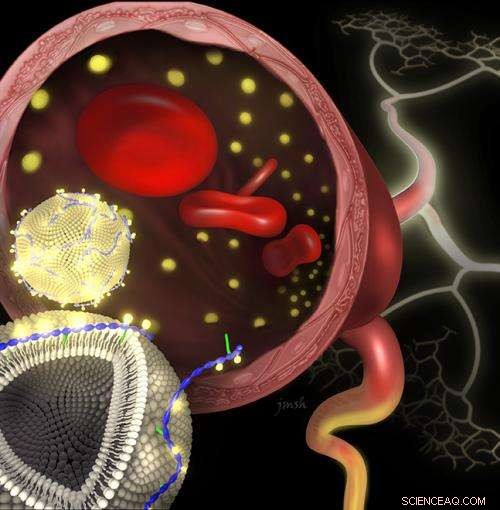
Kredit:Janet Sinn-Hanlon, DesignGroup@VetMed, University of Illinois
(Phys.org) —Når University of Illinois lektor i kemi og biomolekylær teknik Hyunjoon Kong, kandidatstuderende Cartney Smith, og kolleger satte sig for at forbedre MR-billeddannelse (MRI), de vendte den nuværende kontrastmiddelteknologi på hovedet - eller rettere, de vendte det vrangen ud. Den nye forbindelse, de har designet i samarbejde med Illinois' Roger Adams professor i kemi Steven C. Zimmerman, er ikke kun mere effektiv, men også selvsamlende. Kong er også medlem af forskningstemaet Regenerative Biology and Tissue Engineering ved Institute for Genomic Biology.
Når læger foretager en MR, de administrerer et kontrastmiddel:et kemikalie, der, når det injiceres i blodbanen eller indtages af patienten lige før MRI, forbedrer klarheden af strukturer eller organer i det resulterende billede. En fælles klasse af kontrastmiddel, bruges ofte til billeddannelse af blodkar og indre blødninger, indeholder gadolinium, et sjældent jordartsmetal.
For nylig, biomedicinske forskere har fundet måder at øge effektiviteten af visse kontrastmidler ved at forbinde dem med nanopartikler. Kontrastmidlet, der bruges, er pakket indvendigt eller bundet til overfladen af mikroskopiske partikler, som kan designes til at målrette bestemte områder af kroppen eller forlænge midlets aktivitet.
Forskere undersøger nu den multifunktionelle anvendelse af nanopartikler. Hvis partikler kunne fyldes med flere typer kontrastmidler eller farvestoffer i stedet for én, eller et kontrastmiddel sammen med en anden type diagnostisk hjælpemiddel eller medicin, læger kunne mere effektivt teste for og behandle tilstande, og begrænse antallet af injektioner modtaget af patienter.
Ligesom småbørn, der deler et nyt legetøj, selvom, forbindelser pakket sammen til en nanopartikel kan ikke altid spille godt sammen. For eksempel, kontrastmidler kan binde sig til andre kemikalier, reducere deres effektivitet. Ud over, når kontrastmidler er indesluttet i en nanopartikel, de fungerer muligvis ikke så godt. Forsøg på at binde midler til den ydre overflade af nanopartikler via kovalent dannelse er også problematiske, da de kan påvirke aktiviteten af nanopartiklerne eller de forbindelser, de bærer, negativt.
Kong, Smith og kolleger tacklede disse udfordringer ved at bruge interaktioner mellem naturligt forekommende biomolekyler som en guide. Mange typer proteiner er stærkt knyttet til cellemembraner ikke ved kovalente bindinger, men ved summen af flere svagere kræfter - tiltrækningen af positive og negative ladninger, og ikke-polære (olielignende) stoffers tendens til at søge hinanden og undgå vand.
Gruppen antog, at de samme typer kræfter kunne bruges til at fastgøre et kontrastmiddel til overfladen af en type nanopartikel kaldet et liposom, som ligner et lille stykke cellemembran i form af en lillebitte boble. Forskerne designet et "fastener"-molekyle, DTPA-chitosan-g-C18, der opkræves, tiltrække det til liposomet og binde det til kontrastmidlet gadolinium. Et upolært område forankrer det til liposommembranen.
I en række eksperimenter rapporteret i en nylig ACS Nano artikel (DOI:10.1021/nn4026228), Kong og andre demonstrerede, at deres fastgørelsesmolekyle let indsatte sig i membranen af præfabrikerede liposomer. Gadolinium stabilt forbundet med de modificerede nanopartikler i opløsning, og forsøg i dyremodeller viste, at disse nanopartikler producerede klare diagnostiske billeder.
"Strategien fungerer som velcro på molekylært niveau for at klæbe funktionelle enheder til den ydre folder af et liposom, sagde Smith, som var første forfatter på undersøgelsen. "Dette arbejde repræsenterer en ny materialedesignstrategi, der er skalerbar og let implementeret. Udviklingen af forbedrede kontrastmidler har potentiale til direkte at påvirke patienters liv ved at opdage beskadigede blodkar."
En af vanskelighederne ved at arbejde med liposomer er deres tendens til at nedbrydes inde i kroppen. Når de fastgørelsesbelastede liposomer nedbrydes, noget af gadoliniumens effektivitet gik tabt. I en anden undersøgelse offentliggjort i Langmuir (DOI:10.1021/la500412r), Kong og Smith udviklede en proces til kemisk tværbinding af nanopartiklernes komponenter, der forlængede nanopartiklernes levetid under biologiske forhold.
 Varme artikler
Varme artikler
-
 Nikkelblok:Et elements kærlighed-had forhold til batterielektroderMens mangan (blå) udfylder denne lithium-ion batteri nanopartikel jævnt, nikkel (grønne) klumper i visse områder, forstyrrer materialets glatte funktion. Kredit:Chongmin Wang/PNNL Enhver, der ejer
Nikkelblok:Et elements kærlighed-had forhold til batterielektroderMens mangan (blå) udfylder denne lithium-ion batteri nanopartikel jævnt, nikkel (grønne) klumper i visse områder, forstyrrer materialets glatte funktion. Kredit:Chongmin Wang/PNNL Enhver, der ejer -
 Ny metode til at forbedre termisk ledningsevne kunne afkøle computerchips, lasere og andre enhederDette er et par bor -nanoribbons, der sidder sammen på en mikrodelen, der bruges til at måle varmeledningsevne. Kredit:Deyu Li Den overraskende opdagelse af en ny måde at tune og forbedre termisk
Ny metode til at forbedre termisk ledningsevne kunne afkøle computerchips, lasere og andre enhederDette er et par bor -nanoribbons, der sidder sammen på en mikrodelen, der bruges til at måle varmeledningsevne. Kredit:Deyu Li Den overraskende opdagelse af en ny måde at tune og forbedre termisk -
 Bekæmpelse af listeria og andre fødevarebårne sygdomme med nanobioteknologiForskere ved Rensselaer Polytechnic Institute har udviklet en ny metode til at dræbe dødelige patogene bakterier i håndtering og emballering af fødevarer. Brug naturen som deres inspiration, forskerne
Bekæmpelse af listeria og andre fødevarebårne sygdomme med nanobioteknologiForskere ved Rensselaer Polytechnic Institute har udviklet en ny metode til at dræbe dødelige patogene bakterier i håndtering og emballering af fødevarer. Brug naturen som deres inspiration, forskerne -
 Ny super stærk legering opdagetDr. Peter Liddicoat ved siden af atomsonden. (PhysOrg.com)-Internationalt forskerteam har opdaget en ny superstyrke letlegering og fået deres vigtigste fund offentliggjort i Naturkommunikation
Ny super stærk legering opdagetDr. Peter Liddicoat ved siden af atomsonden. (PhysOrg.com)-Internationalt forskerteam har opdaget en ny superstyrke letlegering og fået deres vigtigste fund offentliggjort i Naturkommunikation
- Shard afslører, hvordan Cyperns gamle kongeriger styrede økonomien
- Big data, maskinlæring kaster lys over de asiatiske genplantningssucceser
- Hvad ser en menneskelig celle ud?
- Forskere fanger det mest detaljerede radiobillede af Andromeda-galaksen til dato
- Astronomer skaber skyatlas for varme, Jupiter-lignende exoplaneter
- Optogenetik – at kontrollere neuroner med lys – kan føre til helbredelse af PTSD, Alzheimers


