Fremskridt med atomkraftmikroskop fører til ny brystkræftforskning
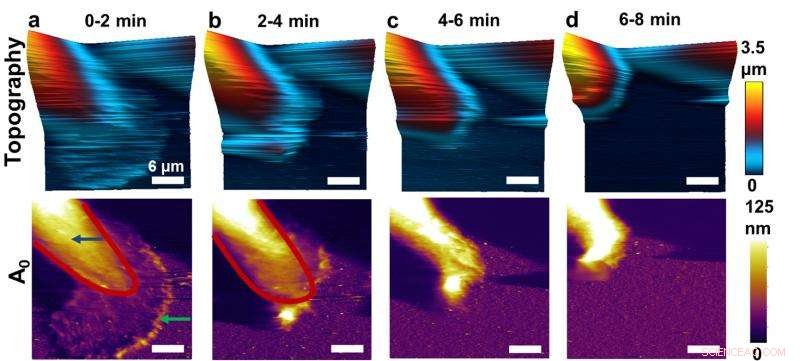
Denne sekvens af atomkraftmikroskop (AFM) -billeder viser før og efter virkninger af at hæmme funktionen af et nøgleprotein i brystkræftceller. Forskere, der udviklede en højhastighedsform for AFM, har vist, hvordan man kan afbilde de fysiske egenskaber af levende brystkræftceller, afsløre nye detaljer. Her, ændringer kan ses i egenskaberne af kræftceller. Kredit:Purdue University billede/Arvind Raman
Forskere, der udviklede en højhastighedsform for atomkraftmikroskopi, har vist, hvordan man kan afbilde de fysiske egenskaber af levende brystkræftceller, for første gang afslører detaljer om, hvordan deaktivering af et nøgleprotein kan føre til metastase.
De nye resultater giver også beviser for de mekanismer, der er involveret i en celles respons på anti-cancer medicin, sagde Arvind Raman, Purdue Universitys Robert V. Adams professor i maskinteknik.
I atomkraftmikroskopi (AFM), en lille vibrerende sonde kaldet en cantilever passerer over et materiale, præcist karakteriserer dens topografi og fysiske egenskaber. Imidlertid, før nu har proceduren været for langsom til at registrere nogle hurtigt skiftende biologiske processer i aktion.
"Før dette fremskridt kunne du kun se før og efter, men ikke hvad der skete i mellem, begivenhedens dynamik, "Raman sagde." Der er beviser baseret på dette arbejde og vores tidligere fund på, at der kan være en mekanisk signatur til lægemiddelresistens. "
Avancerede modeller giver forskere mulighed for at konvertere AFM-data til egenskaber om cellens interne stilladser, kaldet cortical actin cytoskelet, herunder bevægelse af fibre kaldet actin.
Resultaterne er beskrevet i et papir, der vises mandag (29. juni) i forskningstidsskriftet Videnskabelige rapporter , Nature Publishing Groups open access-tidsskrift. Forskerne brugte teknikken til at studere brystkræftceller, sondering af et nøgleenzym kaldet milttyrosinkinase, eller Syk.
Kinaser forårsager phosphorylering af proteiner, en biokemisk proces, der kan ændre enzymer og spiller en væsentlig rolle i en lang række cellulære processer.
"Så hvis du slukker for kinasen, proteiner vil blive dephosphoryleret, og så kan der forekomme ændringer, " sagde Robert L. Geahlen, Fremragende professor i medicinsk kemi ved Purdue. "Vi var i stand til at vise, at slukningen af denne kinase meget hurtigt ændrer cellens fysiske egenskaber. Så det er uden tvivl på grund af fosforyleringsbegivenhederne, der har øjeblikkelig virkning på cytoskeletproteiner."
Artiklen er forfattet af tidligere doktorand Alexander X. Cartagena-Rivera, nu postdoc ved National Institutes of Health's National Institute on Deafness and Other Communication Disorders (NIDCD); Purdue postdoc-forskningsassocieret Wen-Horng Wang; Geahlen; og Raman.
Forskerne studerede brystkræftceller udsat for en kemisk "hæmmer", der blokerer for funktionen af Syk, efterlader cellerne fri til at metastasere. På grund af den nye AFM med højere hastighed, forskerne har for første gang kunnet observere, hvad der sker, når inhibitoren tilsættes.
Efter tilsætning af hæmmeren, aktinbånd udbreder sig over cellen, får cellen til at ændre form.
"Det tager cirka 10 minutter, hvilket er ret hurtigt sammenlignet med mange biologiske processer, "Sagde Raman.
Billederne kan tages med en hastighed på omkring 50 sekunder pr.
"Før vi gjorde dette, ville det tage cirka 15 til 20 minutter at tage et billede, som er for langsom til at observere denne overgangsproces, " han sagde.
Bånd af actin viste sig at bevæge sig i en fejende bevægelse hen over cellen.
"Du tænker på actin som et stillads, men det er et dynamisk stillads, " sagde Raman. "Vi kan se bånd af aktin, der går rundt og ændrer de fysiske egenskaber under overgangen, som ikke var forstået før."
Når Syk mangler eller er deaktiveret, breast cancer cells undergo a process called EMT, or epithelial-mesenchymal transition, causing them to become highly motile and to undergo metastasis.
"If this kinase is in the cells, the cells cannot metastasize, so we've been trying to figure out what the mechanisms are by which you have to get rid of this kinase in order to become highly motile and metastatic, " said Geahlen, who is affiliated with the Purdue Center for Cancer Research. "And that's one of the reasons we were looking at this particular type of cancer cell with this particular form of Syk in it."
One goal of the research is to correlate physical properties of cells with tumor suppression and the action of the kinase on the cell.
The advance in AFM technology was accomplished by two innovations:as the cantilever scans a cell it bends differently depending on the properties of the material being scanned. A laser measures this "deflection, " and models convert the data to reveal information about the material's composition. Previous applications of AFM microscopy to study live cells provided feedback on the amplitude and frequency of the vibrating cantilever, but not the deflection. Imidlertid, that approach takes too long to provide images of the quickly changing processes inside living cells. Providing feedback on the deflection instead has now been shown to increase the imaging speed 10-fold, making the method practical for studying cellular processes.
The other innovation is a technique that enables the cantilever to vibrate at two frequencies simultaneously.
"In one scan we can map the local physical properties of the cell, and we can do it fast enough that we compile maps of the changing cell, "Sagde Raman.
 Varme artikler
Varme artikler
-
 Forskere udvikler en enkel måde at fremstille mikro-superkondensatorer med høj energitæthed(Venstre) Fotografi af ni indbyrdes forbundne mikrosuperkondensatorer. (Højre) Mikrosuperkondensatorer i meget sammenfoldet tilstand. Kredit:Xiao et al. ©2017 American Chemical Society (Phys.org)
Forskere udvikler en enkel måde at fremstille mikro-superkondensatorer med høj energitæthed(Venstre) Fotografi af ni indbyrdes forbundne mikrosuperkondensatorer. (Højre) Mikrosuperkondensatorer i meget sammenfoldet tilstand. Kredit:Xiao et al. ©2017 American Chemical Society (Phys.org) -
 Stabile elektroder til forbedring af trykt elektronikEfter at have introduceret det, der synes at være en universel teknik til at reducere en funktions funktion af en leder inden for printbar elektronik, et team ledet af Georgia Techs Bernard Kippelen h
Stabile elektroder til forbedring af trykt elektronikEfter at have introduceret det, der synes at være en universel teknik til at reducere en funktions funktion af en leder inden for printbar elektronik, et team ledet af Georgia Techs Bernard Kippelen h -
 Bakterieprotein tjener som sensorPrincip for størrelsesdiskrimination af molekyler med bakterielle nanoporer:Når et molekyle placeres i poren dannet af proteinet (over midten), en del af strømmen (rødt spor) er kortvarigt afbrudt af
Bakterieprotein tjener som sensorPrincip for størrelsesdiskrimination af molekyler med bakterielle nanoporer:Når et molekyle placeres i poren dannet af proteinet (over midten), en del af strømmen (rødt spor) er kortvarigt afbrudt af -
 Farvehologram bruger plasmoniske nanopartikler til at lagre store mængder informationForskellige typer nanopartikler, som spreder lys ved forskellige bølgelængder, bruges til at skabe et flerfarvet hologram. Kredit:Montelongo, et al. ©2014 PNAS (Phys.org) —I det 4 th århundrede,
Farvehologram bruger plasmoniske nanopartikler til at lagre store mængder informationForskellige typer nanopartikler, som spreder lys ved forskellige bølgelængder, bruges til at skabe et flerfarvet hologram. Kredit:Montelongo, et al. ©2014 PNAS (Phys.org) —I det 4 th århundrede,


