Sådan holder du nanopartikellarver sikre fra immunsystemets krager
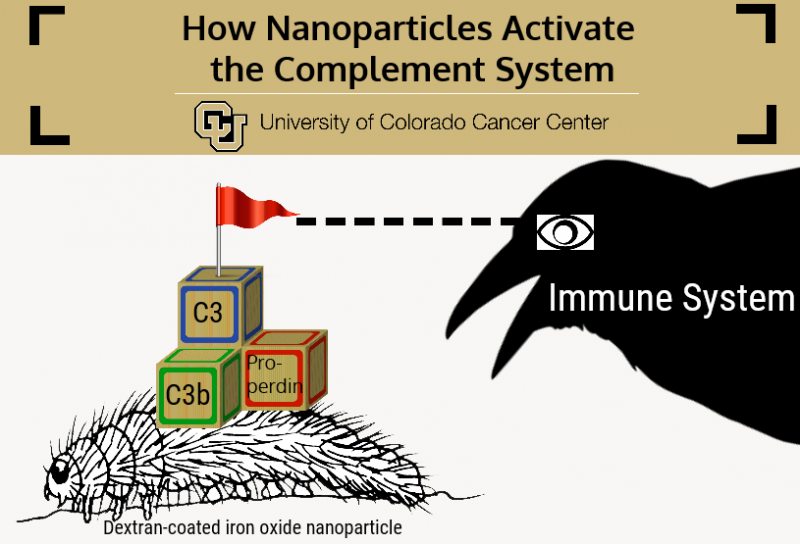
University of Colorado Cancer Study viser, hvordan nanopartikler aktiverer komplementsystemet, potentielt bane vejen for udvidet brug af disse teknologier. Kredit:University of Colorado Cancer Center
I laboratoriet, læger kan knytte kemoterapi til nanopartikler, der er målrettet mod tumorer, og kan bruge nanopartikler til at forbedre billeddannelsen med MR, PET- og CT-scanninger. Desværre, nanopartikler ligner meget patogener - introduktion af nanopartikler til den menneskelige krop kan føre til immunsystemaktivering, hvor i bedste fald, nanopartikler fjernes, før de opfylder deres formål, og i værste fald, begyndelsen af en farlig allergisk reaktion. Et papir fra University of Colorado Cancer Center offentliggjort i dag i tidsskriftet Natur nanoteknologi detaljer, hvordan immunsystemet genkender nanopartikler, potentielt bane vejen for at modvirke eller undgå denne påvisning.
Specifikt, undersøgelsen arbejdede med dextran-coatede jernoxidnanopartikler, en lovende og alsidig klasse af partikler, der bruges som lægemiddelleveringsmidler og MRI-kontrastforstærkere i mange undersøgelser. Som deres navn antyder, partiklerne er små pletter af jernoxid med sukkerkæder.
"Vi brugte flere sofistikerede mikroskopiske tilgange til at forstå, at partiklerne dybest set ligner larver, " siger Dmitri Simberg, PhD, efterforsker ved CU Cancer Center og adjunkt ved Skaggs School of Pharmacy and Pharmaceutical Sciences, avisens seniorforfatter.
Sammenligningen er slående:Jernoxidpartiklen er larvens krop, som er omgivet af fine hår af dextran.
Hvis Simbergs dextran-coatede jernoxidnanopartikler er larver, så er immunsystemet en fed krage, der ville spise dem - dvs. hvis den kan finde dem. Faktisk, immunsystemet har udviklet sig til netop dette formål - at finde og "spise" fremmede partikler - og snarere end én homogen enhed er faktisk sammensat af en håndfuld indbyrdes forbundne systemer, hver specialiseret til at modvirke en bestemt form for invaderende partikel.
Simbergs tidligere arbejde viser, at det er den immunsubkomponent kaldet komplementsystemet, der mest udfordrer nanopartikler. I bund og grund, komplementsystemet er en gruppe på godt 30 proteiner, der cirkulerer gennem blodet og binder sig til invaderende partikler og patogener. Hos mennesker, komplementsystemaktivering kræver, at tre proteiner samles på en partikel -C3b, Bb og properdin - som danner et stabilt kompleks kaldet C3-konverterase.
"Hele komplementsystemets aktivering starter med samlingen af C3-convertase, " siger Simberg. "I dette papir, vi stiller spørgsmålet om, hvordan komplementproteinerne egentlig genkender nanopartikeloverfladen. Hvordan udløses hele denne reaktion?"
Først, det var tydeligt, at dextranbelægningen, der skulle beskytte nanopartiklerne mod angreb af menneskeligt komplement, ikke gjorde sit arbejde. Simberg og kolleger kunne se komplementproteiner bogstaveligt talt invadere barrieren af dextran-hår.
"Elektronmikroskopibilleder viser protein, der kommer ind i partiklen for at røre jernoxidkernen, siger Simberg.
Faktisk, så længe nanopartikelbelægningen tillod nanopartiklerne at absorbere proteiner fra blod, C3-convertasen blev samlet og aktiveret på disse proteiner. Sammensætningen af belægningen var irrelevant - hvis noget blodprotein var i stand til at binde sig til nanopartikler, det førte altid til komplementaktivering. I øvrigt, Simberg og kolleger viste også, at aktivering af komplementsystemet er en dynamisk og vedvarende proces - blodproteiner og C3-konvertase adskiller sig konstant fra nanopartikler, og nye proteiner og C3-konvertaser binder til partiklerne, fortsætter kaskaden af immunsystemaktivering. Gruppen demonstrerede også, at denne dynamiske samling af komplementproteiner ikke kun forekommer i reagensglassene, men også i levende organismer, da partikler cirkulerer i blodet.
Simberg foreslår, at arbejdet peger på udfordringer og tre mulige strategier for at undgå komplementsystemaktivering af nanopartikler:"For det første, vi kunne prøve at ændre nanopartikelbelægningen, så den ikke kan absorbere proteiner, hvilket er en vanskelig opgave; sekund, vi kunne bedre forstå sammensætningen af proteiner absorberet fra blod på partikeloverfladen, som gør det muligt for det at binde komplementproteiner; og for det tredje, der er naturlige inhibitorer af komplementaktivering - for eksempel blodfaktor H - men i forbindelse med nanopartikler, den er ikke stærk nok til at stoppe komplementaktivering. Måske kunne vi få nanopartikler til at tiltrække mere faktor H for at mindske denne aktivering."
På et tidspunkt, begrebet nanomedicin virkede, som om det ville være enkelt - ingeniører og kemikere ville lave en nanopartikel med affinitet til tumorvæv og derefter knytte et lægemiddelmolekyle til det. Eller de ville injicere nanopartikler i patienter, der ville forbedre opløsningen af diagnostisk billeddannelse. Da realiteterne forbundet med brugen af nanopartikler i landskabet af det menneskelige immunsystem viste sig at være mere udfordrende, mange forskere indså behovet for at træde tilbage fra mulig klinisk brug for bedre at forstå de mekanismer, der udfordrer brugen af nanopartikler.
"Dette grundlæggende grundlag er absolut nødvendigt, " siger Seyed Moein Moghimi, PhD, nanoteknolog ved Durham University, Storbritannien, og medforfatteren til Simberg-avisen. "Det er vigtigt, at vi lærer at kontrollere processen med immungenkendelse, så vi kan bygge bro mellem løftet, som nanopartikler demonstrerer i laboratoriet, og deres brug med rigtige patienter i den virkelige verden."
Sidste artikelFørste brug af grafen til at opdage kræftceller
Næste artikelKarakterisering af magnetiske nanovortices forenklet
 Varme artikler
Varme artikler
-
 Kandidatstuderende opfinder nyt kræfttilførselsmiddelSean Hemp dyrker aktivt HeLa-cellekulturer i Timothy E. Longs laboratorium. (Phys.org)—Sean Hemp fra Raleigh, N.C., en ph.d. studerende i kemi på College of Science, hjælper med at opfinde nye ter
Kandidatstuderende opfinder nyt kræfttilførselsmiddelSean Hemp dyrker aktivt HeLa-cellekulturer i Timothy E. Longs laboratorium. (Phys.org)—Sean Hemp fra Raleigh, N.C., en ph.d. studerende i kemi på College of Science, hjælper med at opfinde nye ter -
 Forskere skaber 3-D fuldfarve holografiske billeder med nanomaterialerKredit:Missouri University of Science and Technology Forskere ved Missouri University of Science and Technology skaber en ny tilgang til at rekonstruere 3-D fuldfarve holografiske billeder ved at
Forskere skaber 3-D fuldfarve holografiske billeder med nanomaterialerKredit:Missouri University of Science and Technology Forskere ved Missouri University of Science and Technology skaber en ny tilgang til at rekonstruere 3-D fuldfarve holografiske billeder ved at -
 Biomedicinsk gennembrud:Carbon nanopartikler, du kan lave derhjemmePostdoktor ved University of Illinois, Prabuddha Mukherjee, venstre, bioingeniørprofessorer Rohit Bhargava og Dipanjan Pan, og postdoktorforsker Santosh Misra, ret, rapportere udviklingen af en ny k
Biomedicinsk gennembrud:Carbon nanopartikler, du kan lave derhjemmePostdoktor ved University of Illinois, Prabuddha Mukherjee, venstre, bioingeniørprofessorer Rohit Bhargava og Dipanjan Pan, og postdoktorforsker Santosh Misra, ret, rapportere udviklingen af en ny k -
 Forskerhold bruger excitoner til at tage elektronik ind i fremtidenAllegorisk tegneserie for bedre at forstå, hvad der er en exciton. Kredit:© EPFL, Manuskript:Sarah Perrin, Illustrationer:Xurxo- Adrian Entenza Excitoner kan revolutionere den måde, ingeniører nær
Forskerhold bruger excitoner til at tage elektronik ind i fremtidenAllegorisk tegneserie for bedre at forstå, hvad der er en exciton. Kredit:© EPFL, Manuskript:Sarah Perrin, Illustrationer:Xurxo- Adrian Entenza Excitoner kan revolutionere den måde, ingeniører nær
- Undersøgelse kaster lys over målerinvarians i ultra-koblingskavitets kvantelektrodynamik
- Nye test identificerer forurenet drikkevand på få minutter, ikke uger
- Metal hvisken:At finde en bedre måde at genvinde ædle metaller fra elektronisk affald
- Høst energi
- Jordens byggesten:Forskerholdet genberegner fordelingen af flygtige elementer
- Modellering af hjernens rytmiske elektriske aktiviteter


