In-celle molekylær sigte fra proteinkrystal
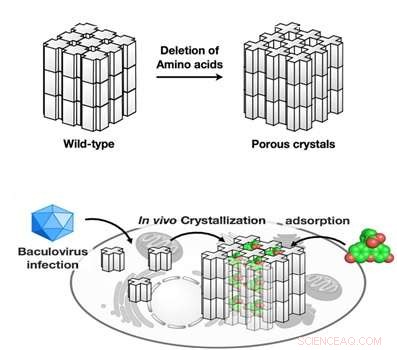
De mutante polyhedrinmonomerer blev krystalliseret i insektceller og brugt til at adsorbere fluorescerende farvestoffer (nederste panel). Kredit:Tokyo Institute of Technology
Forskere ved Tokyo Institute of Technology, RIKEN, og Kyoto Institute of Technology har anvendt rationelt krystaldesign til at skabe proteinkrystaller med udvidet porøst netværk for at akkumulere eksogene molekyler inde i levende celler. Dette arbejde lægger et fundament for konstruktion af stabile selvsamlende krystallinske porøse materialer, som kan koncentrere og bevare bioaktive stoffer i forskellige celletyper.
I naturen, proteiner samles i sofistikerede og højt ordnede strukturer, som sætter dem i stand til at udføre adskillige funktioner, der understøtter forskellige livsformer. Det udsøgte design af naturlige proteiner fik videnskabsmænd til at udnytte det i syntetisk biologi til at konstruere molekyler, der kan samle sig selv til nanopartikler med ønsket struktur, og som kan bruges til forskellige formål såsom gaslagring, enzymkatalyse, intracellulær lægemiddellevering, etc.
Cytoplasmatiske polyhedrosis-vira (cypovirus), der inficerer insekter, er indlejret i proteinkrystaller kaldet polyedre, som beskytter virussen mod beskadigelse. Strukturen af polyederkrystaller (PhC'er) antyder, at de kan tjene som robuste beholdere, der kan inkorporere og beskytte fremmede molekyler mod nedbrydning, at sikre deres sammensætningsmæssige og funktionelle stabilitet.
Oversigt over forskningsresultater
Ekstrem stabilitet af polyedre under barske forhold opnås ved tæt pakning af polyhedrinmonomerer i krystaller med opløsningsmiddelkanaler med meget lav porøsitet, hvilken, imidlertid, begrænser inkorporeringen af fremmede partikler. Forskergruppe ledet af Satoshi Abe og Takafumi Ueno ved Tokyo Institute of Technology antog, at hvis en porøs ramme inde i PhC'er udvides uden at kompromittere krystalstabiliteten, PhC'er kan bruges til akkumulering og opbevaring af eksogene molekyler i levende celler. Som i naturlige PhC'er, polyhedrinmonomerer danner en trimer, forskerne antog, at hvis aminosyrerester ved kontaktgrænsefladen af hver trimer slettes, porøsiteten af de resulterende krystaller ville blive forøget. For at nå dette mål, de gensplejsede polyhedrinmonomerer, som derefter blev udtrykt og selvsamlet i Spodoptera frugiperda IPLB-Sf21AE, larven af en hærormøl, inficeret med baculovirus. De mutante PhC'er opretholdt krystalgitter af vildtype PhC, men havde signifikant udvidet porøsitet (figur) på grund af deletionen af aminosyrerester med omarrangering af intra- og intermolekylære hydrogenbindinger. Som resultat, de konstruerede krystaller kunne adsorbere 2-4 gange flere eksogene molekyler (fluorescerende farvestoffer) sammenlignet med vildtype PhC, med op til 5, 000 gange kondensering af farvestofferne fra 10 uM opløsningen.
Som et næste skridt, forskerne undersøgte de mutante krystallers ydeevne i levende insektceller. PhC'er viste høj stabilitet i det intracellulære miljø. Mest vigtigt, mutantkrystallerne kunne akkumulere og tilbageholde farvestofferne i levende celler, mens de naturlige krystaller ikke kunne.
Rationale krystaldesign brugt af forskere ved Tokyo Institute of Technology giver et kraftfuldt værktøj til strukturel manipulation af selvsamlede proteinkrystaller for at opnå porøse nanomaterialer med regulerede adsorptionsegenskaber. De konstruerede porøse PhC'er kan bruges som proteinbeholdere til in vivo krystalstrukturanalyse af de cellulære molekyler og bioortogonal kemi i forskellige typer af levende celler.
Strukturel analyse af mikrokrystaller
Da der blev opnået små krystaller med kun få mikrons størrelse, strukturanalyserne blev udført ved beamlines BL32XU og BL41XU ved SPring-8, et stort synkrotronstrålingsanlæg, som leverer den kraftigste synkrotronstråling. De højopløselige strukturer blev hurtigt analyseret ved hjælp af et automatiseret dataindsamlingssystem udviklet i RIKEN.
 Varme artikler
Varme artikler
-
 Hvordan bygger man en metal -nanopartikel?En struktur af et ligandbeskyttet Au25-nanokluster. Kredit:Computer-Aided Nano and Energy Lab (C.A.N.E.LA.) Selvom forskere i årtier har været i stand til at syntetisere nanopartikler i laboratori
Hvordan bygger man en metal -nanopartikel?En struktur af et ligandbeskyttet Au25-nanokluster. Kredit:Computer-Aided Nano and Energy Lab (C.A.N.E.LA.) Selvom forskere i årtier har været i stand til at syntetisere nanopartikler i laboratori -
 Små partikler kan skifte frem og tilbage mellem faserIsomerisering er veletableret i små organiske molekyler (f.eks. cis-til-trans transformation af azobenzen), hvorimod bulk uorganiske faststoffer udviser fasetransformationer. Selvom den er lille i stø
Små partikler kan skifte frem og tilbage mellem faserIsomerisering er veletableret i små organiske molekyler (f.eks. cis-til-trans transformation af azobenzen), hvorimod bulk uorganiske faststoffer udviser fasetransformationer. Selvom den er lille i stø -
 Kontakter den molekylære verden gennem grafen nanobåndScanning Tunneling Mikroskopi billede af den nye molekylære enhed og dens grafen nanorribbons kontakter. Kredit:CIC nanoGUNE Et enkelt molekyle kan opføre sig som den mindste elektroniske komponen
Kontakter den molekylære verden gennem grafen nanobåndScanning Tunneling Mikroskopi billede af den nye molekylære enhed og dens grafen nanorribbons kontakter. Kredit:CIC nanoGUNE Et enkelt molekyle kan opføre sig som den mindste elektroniske komponen -
 Forskere udvikler måde at forstørre nanostrukturer til lys, fleksible 3D-trykte materialerForskere har udviklet hierarkisk metallisk metamateriale med flerlags, fraktal-lignende 3D-arkitekturer til at skabe strukturer i centimeter skalaer, der indeholder nanoskala funktioner. Kredit:Jim St
Forskere udvikler måde at forstørre nanostrukturer til lys, fleksible 3D-trykte materialerForskere har udviklet hierarkisk metallisk metamateriale med flerlags, fraktal-lignende 3D-arkitekturer til at skabe strukturer i centimeter skalaer, der indeholder nanoskala funktioner. Kredit:Jim St
- JILA -spinningmetoden bekræfter, at elektronen stadig virker rund
- Forskere foreslår nye højtydende dual-ion-batterier med 3-D porøs struktur
- Sådan måles pH-niveauer
- Hvordan virker en affaldsforbrændingsovn?
- Maskinlæringsalgoritme kvantificerer virkningen af karantæneforanstaltninger på spredning af CO…
- Forskere demonstrerer effektiviteten af en plasma -reaktor til behandling af vand


