Forskere ser mod naturen for at slå kræft
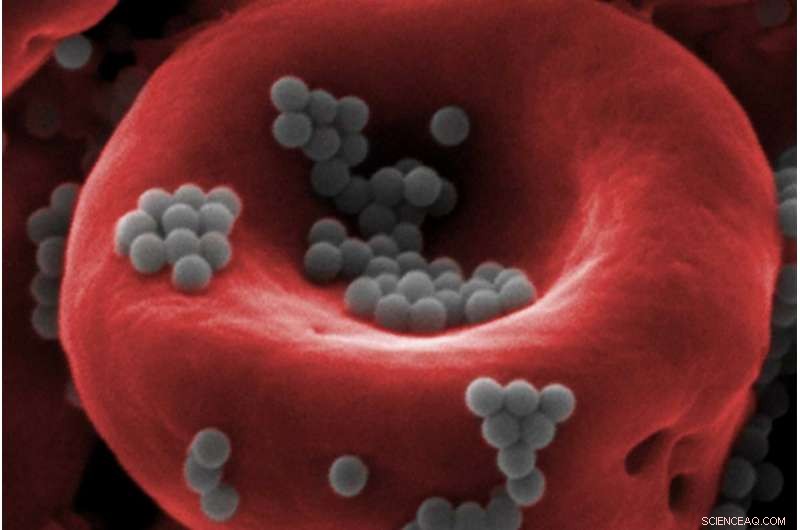
Nanopartikler (grå) knyttet til en rød blodcelle er i stand til at undslippe påvisning af kroppens lever og milt, bane vejen for mere effektiv, mindre giftig medicinafgivelse. Kredit:Wyss Institute ved Harvard University
Hvert år, mere end 18 millioner mennesker rundt om i verden fortælles, "Du har kræft." I USA, næsten halvdelen af alle mænd og mere end en tredjedel af kvinderne vil udvikle en form for kræft i løbet af deres liv, og 600, 000 plus dør af det årligt. På trods af de milliarder af dollars og utallige nye behandlinger, der er blevet kastet over det, siden præsident Richard M. Nixon erklærede "krig" mod sygdommen i 1971, kræft nægter at blive slået.
Hvorfor forbliver det sådan en formidabel fjende? Trods alt, det har været kendt siden Nixons tid, at uoprettede genetiske skader kan få celler til at vokse ukontrolleret, som ses som årsagen til kræft. Men denne forståelse har ikke vist vejen til en oplagt behandling. Forskning i kræftbiologi har afsløret, at det er en af de mest komplekse og snigende menneskelige sygdomme af forskellige årsager.
Først, kræft kan være forårsaget af en række faktorer, fra virusinfektioner til eksponering for kræftfremkaldende kemikalier til simpelt uheld. En patients lungekræft kan være forårsaget af en helt anden konstellation af mutationer end en andens, og et lægemiddel, der retter sig mod en bestemt mutationsprofil, gavner kun en undergruppe af patienter. Desuden, kræftceller udvikler ofte spontant nye mutationer, begrænser effektiviteten af genetisk målrettede lægemidler.
Sekund, kræft er forårsaget af funktionsfejl i kroppens egne celler, så det er svært at designe lægemidler, der kun er målrettet mod kræftceller, mens de skåner sunde.
Tredje, mens genetiske mutationer kan drive kræftdannelse, kræftformer kan holde op med at vokse og forblive i dvale i årevis, tyder på, at der er flere faktorer i spil end genmutation alene.
Og endelig, kræft har en række forskellige "tricks", der gør det muligt for den at gemme sig fra kroppens meget årvågne immunsystem, lade det vokse uopdaget og ukontrolleret indtil, tit, det er for sent.
Kræftbehandlingsregimer gennem det 19. og 20. århundrede var stort set begrænset til et aggressivt triumvirat af kirurgi, stråling, og kemoterapi, som alle har traumatiske bivirkninger og kan bringe patienter på randen af døden i navnet på at redde deres liv. Efterhånden som vores viden om sygdommen er blevet mere nuanceret gennem årtier, der er sket et paradigmeskifte på området, centreret om erkendelsen af, at angreb på en kompleks sygdom med stumpe værktøjer ikke er den mest effektive tilgang. En bølge af nye terapeutiske strategier – inklusive immunterapi, nanoteknologi, og personlig medicin – giver håb til patienter, for hvem traditionelle behandlinger har slået fejl, og tilbyder potentialet for langvarige helbredelser.
Forskere ved Wyss Institute for Biologically Inspired Engineering med ekspertise inden for områder lige fra molekylær cellebiologi og immunologi til materialevidenskab, kemiteknik, mekanobiologi, og DNA-origami er i spidsen for flere af disse nye tilgange. Deres forskning, forenet af det fælles princip om at efterligne naturen, har potentiale til at gøre eksisterende behandlinger bedre, skabe nye, og endda forhindre kræft i at starte i første omgang.
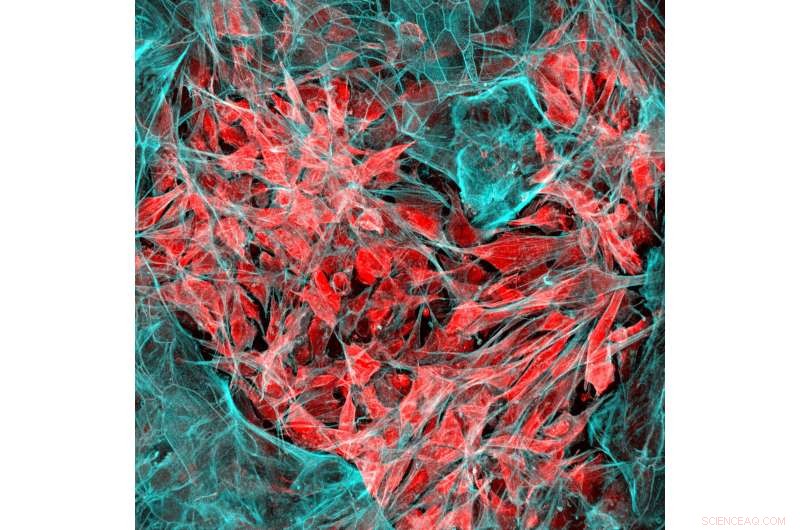
Lungekræftceller (røde) invaderer menneskeligt lungevæv (blåt). Kredit:Wyss Institute ved Harvard University
Bedre medicintilførsel er i vores blod
Kemoterapi har været rygraden i kræftbehandling i det sidste halve århundrede, fordi det infunderer lægemidler i blodbanen for at dræbe kræftceller, der deler sig hurtigt i hele kroppen. Imidlertid, da kemoterapi systemisk retter sig mod alle hurtigtvoksende celler, det kan også beskadige tarmene, knoglemarv, hud, hår, og andre dele af kroppen, og skal i nogle tilfælde gives i så høj en dosis, at den næsten dræber patienten i løbet af behandlingen. Bestræbelser på at gøre kemoterapilægemidler mindre giftige har omfattet indkapsling af dem i nanopartikler, der kun frigiver dem, når de når deres tilsigtede placering, men mindre end 1 procent af nanopartikelindkapslede lægemidler når faktisk deres mål, som den menneskelige lever og milt aggressivt filtrerer dem ud af blodet.
Samir Mitragotri, et kernefakultetsmedlem ved Wyss Institute, besluttede at anvende kemiteknik på problemet med at holde medicin i blodbanen længe nok til at udføre deres arbejde. Det første han stod over for var, at røde og hvide blodlegemer cirkulerer gennem blodet flere gange om dagen, tilsyneladende undslipper påvisning og ødelæggelse af leveren og milten.
"Jeg troede, "Hvis disse celler naturligt ikke fjernes fra blodbanen, måske kan vi også bruge dem til at hjælpe nanopartiklerne med at blive der, i stedet for at skabe en ny og dyr forklædning for at beskytte nanopartiklerne, " sagde Mitragotri, Hiller Professor of Bioengineering og Hansjörg Wyss Professor of Biologically Inspired Engineering ved Harvard John A. Paulson School of Engineering and Applied Sciences (SEAS).
Mitragotris laboratorium fandt ud af, at nanopartikler knyttet til røde blodlegemer faktisk ignoreres af leveren og milten hos mus, og nanopartiklerne skæres af og aflejres i væv, når blodcellerne presser sig særligt tæt gennem de små kapillærer, der leverer blod til organer. Ved at injicere blodcellebundne nanopartikler i et blodkar direkte opstrøms for hele menneskelunger, forskerne var i stand til at få 41 procent af dem til at akkumulere i lungevævet – langt over de sædvanlige 1 procent.
"Simpelthen ved at ændre, hvilket blodkar vi injicerer nanopartiklerne i, vi kan levere en meget højere dosis af et lægemiddel til dets tilsigtede organ, og stole på kroppens naturlige rydningsmekanisme for at slippe af med partikler, der ikke når målet. Vi kan endda få nogle nanopartikler til at målrette hjernen, " sagde Mitragotri.
På trods af sit dårlige ry, kemoterapi er usandsynligt at gå nogen steder snart, da forskning har fundet ud af, at nye terapier virker bedst, når de gives i kombination med kemoterapi. Men teknologier som blodcellebundne nanopartikler kunne hjælpe med at reducere den dosis, der skal administreres, og øge kemoterapiens effektivitet, forbedring af livskvaliteten for kræftpatienter verden over.
Mitragotri har også fundet succes med at anvende denne nanopartikel "rygsæk" strategi på hvide blodlegemer kaldet monocytter, som differentierer til immunceller kaldet makrofager, der bekæmper sygdomme, herunder kræft. Ikke kun er monocytter i stand til at bære deres nanopartikel-lægemiddelbelastninger med sig, når de infiltrerer væv (hvilket kan hjælpe med at levere lægemidler til tumorer dybt inde i organer), men nanopartiklerne kunne en dag bruges til at kontrollere selve monocytterne.

Wyss Institutes kræftvaccine efterligner kroppens lymfeknuder ved at præsentere antigener fra en patients tumor til dendritiske celler, som så kan igangsætte et immunrespons mod kræft. Kredit:Wyss Institute ved Harvard University
"En af de luskede ting, tumorer kan gøre, er at slukke makrofager på samme måde, som de slukker for andre immunceller, sådan at op til halvdelen af en tumor kan være lavet af sovende makrofager, Mitragotri forklarede. "Hvis vi kan levere et kemisk signal til monocytter via en nanopartikelrygsæk, der holder dem i 'tændt' tilstand, efter at de differentieres til makrofager, de kunne være meget mere effektive til at angribe en tumor i stedet for at blive en del af den."
Skabe et sikkert rum for immunceller
Ved at udforske, hvordan styring af immunceller kan hjælpe med at dræbe kræft, Mitragotri dypper sine tæer i den spirende immuno-onkologiske bevægelse, hvorfor det er bedre at modificere en patients immunsystem (som allerede er designet til at jage og dræbe defekte celler), så det kan overvinde kræftens undvigende taktik, end at forsøge at designe et nyt lægemiddel til enhver form for kendt cancer. FDA har godkendt en række immunterapi-tilgange i de seneste år, herunder "checkpoint inhibitor" medicin, der fjerner bremserne for immunceller, der er blevet inaktiveret af kræftceller, og T-celle terapier, som involverer fjernelse af en patients T-celler, konstruere dem til at angribe kræften, multiplicere dem, og infunderer dem tilbage i kroppen.
En nyere taktik, kræftvacciner, forsøger at modificere en patients immunsystem indefra, så det ikke kun angriber eksisterende tumorer, men skaber også en immun "hukommelse" til at ødelægge fremtidige kræftsvulster. Imidlertid, Det har vist sig at være en udfordring at konstruere, at processen skal foregå fuldstændigt i kroppen. Den eneste kræftvaccine, som FDA har godkendt indtil videre, var Provenge, i 2010. Det var en kommerciel fiasko på grund af dens store $93, 000 prisskilt og kompliceret, dage lang behandlingsproces, der krævede flere infusioner.
Men én person var begejstret snarere end skuffet over Provenges offentlige fiasko:David Mooney, et stiftende kernefakultetsmedlem af Wyss og Robert P. Pinkas familieprofessor i bioingeniør ved SEAS. "Mit laboratorium har haft en langvarig interesse i cellebaserede terapier for sygdomme som kræft. Vi syntes, at konceptet med at træne kroppens eget immunsystem til at bekæmpe kræft var virkelig smukt, men vi spekulerede på, om der var en måde, vi kunne forenkle det ved at flytte hele processen ind i kroppen i stedet for at lave dele af den i et laboratorium, som Provenge påkrævet."
Kroppen har en naturlig træningsbane i form af dens lymfeknuder, som rummer immunceller kaldet dendritiske celler, der bliver aktiveret og igangsætter et immunrespons, når de opdager tegn på et invaderende patogen fra lymfekarrene. Kræftceller, imidlertid, udskiller immunsuppressive signaler, der kan forstyrre denne proces. En materialeforsker og kemiingeniør af uddannelse, Mooney indså, at hvis han kunne konstruere og implantere en kunstig lymfeknude lavet af et materiale, der var forskelligt fra resten af kroppen (og derfor beskyttet mod kræftens indflydelse), det kan give et sikkert tilflugtssted for at aktivere dendritiske celler, som så ville udløse immunsystemets angreb på kræften.
Hans laboratorium har gjort netop det, skabe en kræftvaccine i form af en svampet disk på størrelse med en aspirintablet, der implanteres i en patient og nedbrydes biologisk, når den har gjort sit arbejde. I det væsentlige en kunstig lymfeknude, vaccinen indeholder signaler, der tiltrækker dendritiske celler og aktiverer dem med proteiner, der findes på patientens tumorceller. De aktiverede dendritiske celler rejser derefter til den nærmeste lymfeknude, hvor de træner andre typer immunceller til at genkende og ødelægge tumoren. Dette kan give den ekstra fordel ved at beskytte mod gentagelser af kræften - selv et andet sted - da de trænede T-celler kan formere sig og cirkulere gennem kroppen på udkig efter den samme slags tumorceller til at angribe og ødelægge.
Dramatiske reaktioner hos kræftmus, der modtog vaccinen, ansporede Mooney og hans samarbejdspartnere ved Dana-Farber Cancer Institute (DFCI) til at starte et fase 1 klinisk forsøg med støtte fra begge institutter, for at se, om det havde samme effekt hos menneskelige patienter. This kind of study is usually undertaken by hospitals and pharmaceutical companies, but rarely inside academia. In traditional pharmaceutical and biotech environments the process of getting such an innovation into clinical trials usually takes six or seven years, in this case the vaccine was tested in its first patient just three years after initial publication of its development. The results attracted the attention of the drug giant Novartis, which licensed the technology from the Wyss Institute in 2018 and took the reins for future clinical trials, with plans to develop the concept into a treatment for multiple kinds of cancer.
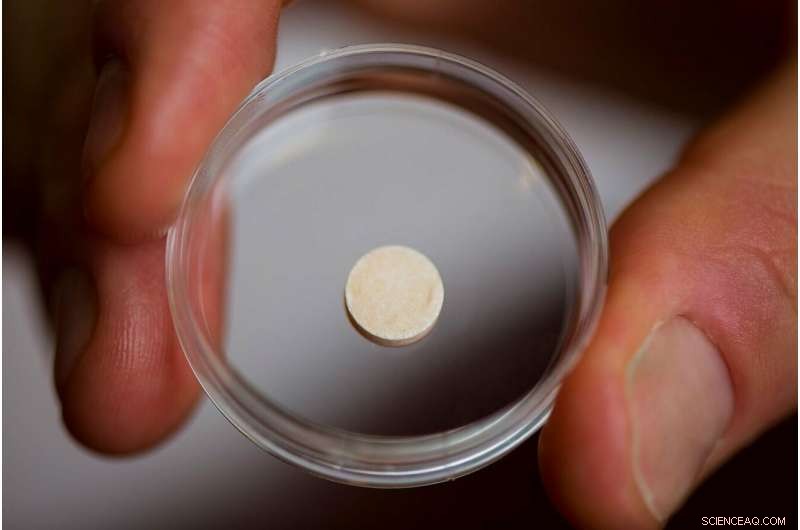
The vaccine is about the size of an aspirin tablet, and is placed inside a patient’s body using a simple incision. It also biodegrades safely, and multiple vaccines can be implanted in the same patient. Kredit:Wyss Institute ved Harvard University
"The Wyss Institute was just starting, and we knew we wanted to focus on translating discoveries from the lab to the clinic, " said Mooney. "So we saw the cancer vaccine not only as a treatment with real potential to help lots of patients, but also as an opportunity to create a path for moving novel therapies out of academia and into the real world faster. There is no way I could have run a clinical trial out of my laboratory, so being able to build a team inside the Wyss to do the experiments and manufacturing needed for the FDA application, and partnering with DFCI to organize and run the clinical trial, was really what allowed us to get to the point where we're implanting the vaccines in cancer patients so quickly."
One such patient, profiled in a recent Boston Globe article, remains cancer-free nearly two years after being vaccinated for advanced melanoma. But Mooney is not content to rest on his laurels. "Cancer is a complex disease, and it's unlikely there will be a single answer for all people and all kinds of cancer, so we need to keep exploring different approaches, " han sagde.
One of these approaches is a partnership with another Wyss faculty member, William Shih, who has long been interested in how his research on DNA molecules that self-assemble into defined 3-D structures—also known as DNA origami—can improve the precision with which cancer therapy is delivered. Shih and Mooney are working on a joint project to see if DNA origami–based nanostructures can be incorporated into the cancer vaccine to enhance its ability to create a sustained immune response.
"When dendritic cells are activated, either in a lymph node or in the cancer vaccine, they have a decision to make:Do they initiate an antibody response, where antibodies are produced that bind to a specific pathogen and mark [the cancer cells] for destruction, or do they initiate a T-cell response, where they send T cells to destroy the pathogen directly?" explained Shih, a professor of biological chemistry and molecular pharmacology at DFCI and Harvard Medical School (HMS). "We want to nudge them toward the T-cell response, because it's a more effective way to kill cancer cells."
Shih's DNA origami nanostructures take advantage of the fact that DNA is a very stable and predictable compound thanks to the strong bonds between its four chemical bases. By constructing strands of DNA whose sequences of bases along their length are precisely known, Shih and his lab have been able to design 3-D DNA structures that effectively build themselves like automated Lego blocks, and whose properties can be tuned down to the nanoscale.
For the cancer vaccine, Shih's lab has designed a DNA "cask" structure that presents a densely packed, precisely arranged display of ligands, or molecules that bind to other molecules, which are usually found on pathogens like bacteria or viruses and are recognized by the body's immune system as foreign. These ligands essentially produce a danger signal recognized by dendritic cells, and can make them choose to initiate a T-cell immune response more often than an antibody response. "Our initial data suggest that the precise patterning of ligands we're able to achieve with DNA origami make a big difference in activating the dendritic cells the way we want them to be activated, " Shih said. "We have this miracle [vaccine]. Let's make it better."
A Neighborhood Watch for cancer
Immunology is all the rage for treating cancers after they occur, but every cancer arises from what was once a normal cell. What if we could tease out exactly what promotes the development of cancer and find a way to reduce the chances it will form in the first place? That's a tall order, as hundreds of substances are known to cause cancer, hundreds more are suspected but unproven carcinogens, and other factors such as lifestyle and genetics all conspire to damage our DNA.
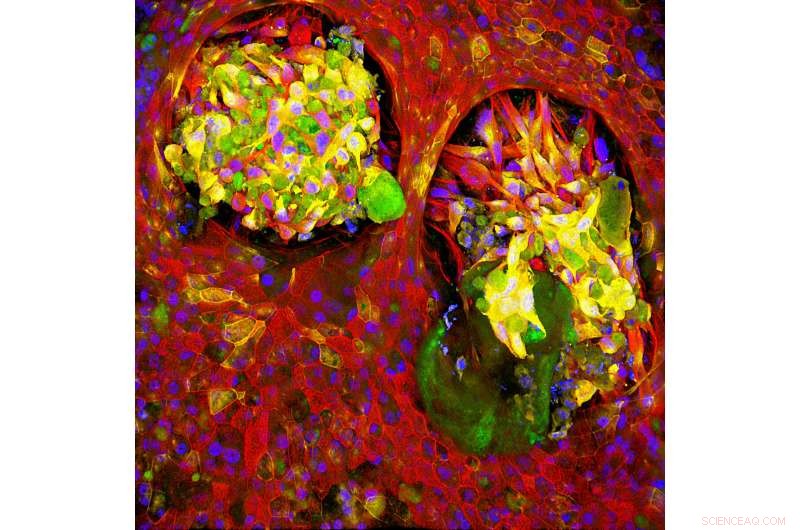
Healthy lung tissue (red) surrounds cells that express markers typically found on both cancerous and healthy cells (green and yellow) in a Lung Cancer Chip, indicating that the relationship between normal and cancerous cells is more complex than originally thought. Kredit:Wyss Institute ved Harvard University
But some causes play an outsized role in cancer's development, such as chronic inflammation, which is associated with nearly 25 percent of all human cancers. Research being undertaken by the Wyss Institute's founding director, Donald Ingber is now investigating the possibility of treating the inflammation of the connective tissue and blood vessels that surround and support organs (known collectively as the stroma) rather than directly attacking tumors themselves.
"Understanding how stromal tissues can influence the development of cancer has intrigued me personally since the time I was a graduate student, " said Ingber, who is also the Judah Folkman Professor of Vascular Biology at HMS and Boston Children's Hospital and a professor of bioengineering at SEAS. "We and others have shown that changes in the physical structure and composition of the stroma can promote cancer formation and, omvendt, that putting cancerous cells into a healthy stromal environment can suppress tumor growth, suggesting that targeting the tumor microenvironment could lead to new cancer-reversal therapies."
Ingber is part of a global research team tackling this problem from multiple angles as part of Cancer Research UK's Grand Challenge, a competition it won earlier this year. Key to the project is Ingber's organ chip technology, which allows researchers to carry out human organ–level experimentation in vitro. Each organ chip is a microfluidic culture device containing hollow microchannels that can be lined with living human epithelial and stromal cells, which experience physical conditions similar to those found in the body, including blood flow, breathing motions in the lung, peristalsis in the intestine, og så videre. The Wyss Institute has created organ chips that faithfully mimic the lung, nyre, intestine, bone marrow, hjerne, og mere, allowing researchers to grow tumor cells within the natural microenvironments found in the body and then test treatments without exposing animals or patients to potentially harmful conditions.
"Our organ chips have shown us time and time again that in order for organ cells to function normally, they have to be provided with the right microenvironment, " said Ingber. "For this project, we will build models of different stages of cancer progression using cells isolated from human patients to understand how interactions between stromal cells and organ-lining cells change as inflammation-associated cancers form, as well as develop new ways to combat this response."
By combining organ chips with bioinformatics and machine-learning approaches, the team hopes to identify new stromal-targeted treatments that can restore inflamed tissue to its healthy form, thereby preventing cancer progression, or induce cancerous or precancerous tissues to revert to a more normal state. By studying human cancer progression in vitro, the team also hopes to discover new diagnostics that can be used to identify the small subset of patients with inflammation-associated premalignant conditions, such as Barrett's esophagus or ulcerative colitis, that might progress to cancer.
"Treating cancer is ultimately going to need to be a multifaceted approach, because the disease itself is so multifaceted, " Ingber said. "The Wyss Institute was founded on the basis of bringing people together from different disciplines to tackle big problems in medicine through communication and collaboration among experts with a broad range of different perspectives. Doing that within the Wyss Institute has led to advances like organ chips, and doing that at a larger scale, such as with the Grand Challenge, allows whole institutions to put their resources together and drive real change for millions of patients living with devastating diseases like cancer worldwide."
Whether targeting blood cells, the immune system, or stromal tissue, all of these projects are guided by the principle of using existing biological elements as the basis for new therapies, rather than trying to invent new cures from scratch.
"The human body is a marvel of biological engineering that has been tuned over millions of years to be able to fight off threats and heal itself, " said Ingber. "When we can recognize its inherent abilities and work with them rather than against them, we are taking full advantage of all the experimentation that evolution has already done for us. We believe this type of interdisciplinary, bio-inspired approach can help create more new treatments for cancer and other complicated diseases much more effectively than traditional drug development strategies."
Denne historie er offentliggjort med tilladelse fra Harvard Gazette, Harvard Universitys officielle avis. For yderligere universitetsnyheder, besøg Harvard.edu.
 Varme artikler
Varme artikler
-
 En selvdrevet hjertemonitor tapet til hudenKredit:CC0 Public Domain Forskere har udviklet et menneskevenligt, ultra-fleksibel organisk sensor drevet af sollys, som fungerer som en selvdrevet hjerteovervågning. Tidligere har de udviklede en
En selvdrevet hjertemonitor tapet til hudenKredit:CC0 Public Domain Forskere har udviklet et menneskevenligt, ultra-fleksibel organisk sensor drevet af sollys, som fungerer som en selvdrevet hjerteovervågning. Tidligere har de udviklede en -
 Nanoenheder viser, hvordan celler ændrer sig med tiden, ved at spore indefraPå dette tidspunkt i udviklingen, embryokromosomerne (som fremstår røde i midten) forbereder sig på at adskilles under den første celledeling. Enhedens ben kan ses fluorescerende grønt, med grønt-fluo
Nanoenheder viser, hvordan celler ændrer sig med tiden, ved at spore indefraPå dette tidspunkt i udviklingen, embryokromosomerne (som fremstår røde i midten) forbereder sig på at adskilles under den første celledeling. Enhedens ben kan ses fluorescerende grønt, med grønt-fluo -
 Nanokompositter med rige iltmuligheder fremmer følsom elektroanalyse af Hg (II)Figur:a) og b) SEM af CeO 2 (550 grader C) og Ru/CeO 2 , henholdsvis; c) og d) TEM for CeO 2 (550 grader C) og Ru/CeO 2 , henholdsvis; e), f) og g) FT-IR 、 UV-Vis og EPR-spektrene for CeO 2
Nanokompositter med rige iltmuligheder fremmer følsom elektroanalyse af Hg (II)Figur:a) og b) SEM af CeO 2 (550 grader C) og Ru/CeO 2 , henholdsvis; c) og d) TEM for CeO 2 (550 grader C) og Ru/CeO 2 , henholdsvis; e), f) og g) FT-IR 、 UV-Vis og EPR-spektrene for CeO 2 -
 Stærkere, bedre solceller:Graphen -forskning om nye energikapaciteterAdrian Hunt. Kredit:Mark Ferguson (Phys.org) - Der er meget at lære om grænserne for forskning i solenergi, især når det kommer til nye avancerede materialer, som kan ændre, hvordan vi udnytter en
Stærkere, bedre solceller:Graphen -forskning om nye energikapaciteterAdrian Hunt. Kredit:Mark Ferguson (Phys.org) - Der er meget at lære om grænserne for forskning i solenergi, især når det kommer til nye avancerede materialer, som kan ændre, hvordan vi udnytter en
- Hvilke planter lever i Atlanterhavet?
- Hvilke produkter får man, når man blander en syre og med en base?
- Rossi X-ray Timing Explorer afslutter missionen efter at have lyttet til universet
- Forskere opdager årsagen til vidt forskellige varmeledningsevner i superatomiske strukturelle analo…
- Revolutionerer stofopdagelse med RNA i søgelyset
- Første kunstige intelligens Google Doodle indeholder Bach


