Funktionsbaseret sekventeringsteknik tillader analyse af kun en enkelt bakteriecelle
Design af RAGE-chippen. Kredit:af Xu Teng
En ny funktionsbaseret sekvenseringsteknik, der bruger en optisk pincet og drager fordel af tyngdekraftens egenskaber, lader forskere analysere bakterieceller én efter én. Studiet, udført af forskere fra Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT) fra Chinese Academy of Sciences, blev udgivet i Lille den 9. juni.
Bakterieceller er så små, at det har været meget svært at analysere kun én bakteriecelle, eller bakterie, på et tidspunkt. Som resultat, mange af dem, nogle gange millioner ad gangen, skal analyseres samtidigt. Dette fortæller os meget om gruppen som helhed, men det forhindrer forskere i at kunne undersøge sammenhængen mellem en enkelt bakteries genotype, eller komplet sæt af gener; og dens fænotype, eller det sæt af egenskaber, der er et resultat af samspillet mellem dets gener og miljøet.
En simpel måde at tænke på forskellen mellem genotype og fænotype er at bemærke, at mens en enkelt majsplantes genotype kan tillade den at vokse tre fod høj, hvis der ikke tilføres meget gødning, så kan majsplantens fænotype være, at den kun voksede til at blive to fod høj.
Analyse af sammenhængen mellem genotype og fænotype er ligetil for så stor en organisme, og også meget nyttigt.
Lignende indsigt om genotype-fænotype forholdet af en enkelt bakterie, ikke mindst med hensyn til infektionssygdomme, har længe været eftersøgt, men hindret af en bakteries størrelse, som typisk kun er nogle få milliontedele meter lange.
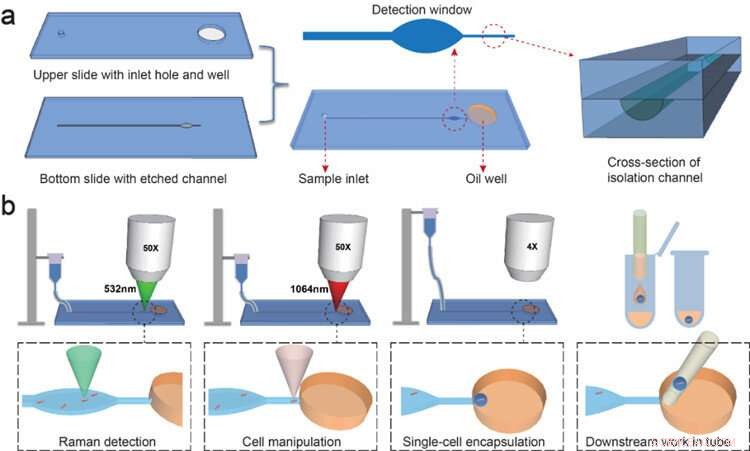
Forskere fra Single-Cell Center på QIBEBT har udviklet en bakterieprofileringsteknik kaldet Raman-Activated Gravity-driven single-cell Encapsulation and Sequencing, eller RAGE-sekventering. I teknikken, de enkelte cellers fænotyper analyseres én efter én, derefter omhyggeligt pakket i en 'picoliter mikrodråbe' (en trilliontedel af en liter), der eksporteres og indekseres i en celle pr. reagensglas måde klar til gensekventering senere.
Processen involverer en RAGE 'chip' af to kvartslag bundet sammen og som har et indløbshul, olie brønd, og mikrokanal ætset ind i dem. 'Optisk pincet', eller en meget fokuseret laserstråle, der frembringer en tiltrækkende eller frastødende kraft, manipulerer bakterien i væske gennem kanalen, assisteret af tyngdekraften.
Formen, bakteriens struktur og metaboliske egenskaber - i det væsentlige dens fænotype - undersøges derefter via et detektionsvindue ved hjælp af 'Raman-spektroskopi', en analytisk teknik, der udnytter lysets interaktion med de kemiske bindinger i et materiale.
"Endelig er bakterien indkapslet i mikrodråben, som derefter overføres til et rør til gensekventering eller dyrkning af cellen, " sagde Prof. Ma Bo, tilsvarende forfatter til undersøgelsen.
Mikrodråbeemballagen er ekstremt vigtig, da det tillader den meget lille mængde DNA i en enkelt bakteriecelle at blive amplificeret på en meget jævn måde, en nøgleudfordring for at afkode sit genom fuldt ud, ifølge Xu Teng, en kandidatstuderende på holdet, der udviklede metoden.
"Vi er i stand til, direkte fra en urinprøve, opnå antibiotikaresistensegenskaber og en i det væsentlige komplet genomsekvens samtidigt fra præcis én celle. Dette giver den højest mulige opløsning til bakteriel diagnose og lægemiddelbehandling, " sagde prof. Xu Jian, en anden tilsvarende forfatter til undersøgelsen.
Baseret på denne teknologi, forskerne har udviklet et instrument kaldet CAST-R til at understøtte hurtig antibiotikaudvælgelse og genomsekventering af patogener, alt sammen på niveau med én celle. Dette instrument betyder meget hurtigere og mere præcis antibiotikabehandling, og meget højere følsomhed til at spore og bekæmpe bakteriel antibiotikaresistens, som er en stor trussel mod det menneskelige samfunds fremtid.
 Varme artikler
Varme artikler
-
 Referencemateriale kan hjælpe med forskning i nanomaterialers toksicitetTEM-billede viser den krystallinske struktur i nanoskala af titaniumdioxid i NIST SRM 1898 (farve tilføjet for klarhedens skyld.) Kredit:Impellitteri/EPA (Phys.org) – National Institute of Standar
Referencemateriale kan hjælpe med forskning i nanomaterialers toksicitetTEM-billede viser den krystallinske struktur i nanoskala af titaniumdioxid i NIST SRM 1898 (farve tilføjet for klarhedens skyld.) Kredit:Impellitteri/EPA (Phys.org) – National Institute of Standar -
 Brug af nanomaskiner til at hjælpe med at bekæmpe krigen mod diabetesKredit:CC0 Public Domain Antidiabetiske lægemidler kan blive billigere og mere tilgængelige takket være et gennembrud fra CSIRO, Australiens nationale videnskabsagentur. Forskere fra CSIROs Synth
Brug af nanomaskiner til at hjælpe med at bekæmpe krigen mod diabetesKredit:CC0 Public Domain Antidiabetiske lægemidler kan blive billigere og mere tilgængelige takket være et gennembrud fra CSIRO, Australiens nationale videnskabsagentur. Forskere fra CSIROs Synth -
 Et gennembrud inden for dråbemanipulationNår en kold/varm eller flygtig dråbe frigives på en smurt piezoelektrisk krystal (lithiumniobat) ved omgivelsestemperatur, dråben driver øjeblikkeligt en lang afstand. Kredit:University of Hong Kong
Et gennembrud inden for dråbemanipulationNår en kold/varm eller flygtig dråbe frigives på en smurt piezoelektrisk krystal (lithiumniobat) ved omgivelsestemperatur, dråben driver øjeblikkeligt en lang afstand. Kredit:University of Hong Kong -
 Grafen plasmoner bliver ballistiskeSimulering og observationer af formerende plasmoner i bornitrid-heterostruktur. Kredit:ICFO At klemme lys ind i små kredsløb og kontrollere dets strøm elektrisk er en hellig gral, der er blevet et
Grafen plasmoner bliver ballistiskeSimulering og observationer af formerende plasmoner i bornitrid-heterostruktur. Kredit:ICFO At klemme lys ind i små kredsløb og kontrollere dets strøm elektrisk er en hellig gral, der er blevet et


