Forskere opfinder verdens mindste biomekaniske forbindelse
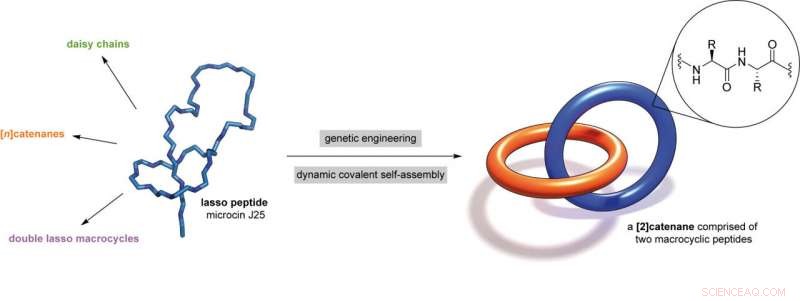
Ved at konstruere et naturligt forekommende lassopeptid, Princeton University-forskere har skabt verdens mindste sammenlåsende biomekaniske struktur. Kredit:Hendrik V. Schröder og A. James Link
Forskere ved Princeton University har bygget verdens mindste mekanisk sammenkoblede biologiske struktur, en vildledende simpel kæde med to ringer lavet af små aminosyrestrenge kaldet peptider.
I et papir udgivet 23. august i Naturkemi , holdet detaljerede et bibliotek af sådanne strukturer lavet i deres laboratorium - to sammenlåste ringe, en ring på en håndvægt, en daisy chain og en sammenlåst dobbelt lasso - hver omkring en milliardtedel meter i størrelse. Undersøgelsen viser også, at nogle af disse strukturer kan skifte mellem mindst to former, lægger grunden til en biomolekylær switch.
"Vi har været i stand til at bygge en masse strukturer, som ingen har været i stand til at bygge før, " sagde A. James Link, professor i kemi og biologisk teknik, undersøgelsens hovedforsker. "Dette er de mindste gevind eller sammenlåsende strukturer, du kan lave ud af peptider."
For at lave disse gadgets, døbt mekanisk sammenkoblede peptider, eller MIP'er, forskerne brugte genteknologi til at manipulere individuelle aminosyrer i et naturligt forekommende lassopeptid, microcin J25, og dirigere peptidet til selv at samle sig til nye former.
De omgik også behovet for de skrappe opløsningsmidler og metalioner, der blev brugt til at bygge lignende syntetiske molekylære arkitekturer, arbejde, der var fokus for 2016 Nobelprisen i kemi. Dette arbejde, ved hjælp af en enkelt-pot protokol i vand, udnytter minimal kontrol over peptidernes eget formfindingsprogram til at skabe en helt ny klasse af teknologi.
"Det bygger virkelig en bro mellem den biologiske verden, "Link sagde, "og hvad der indtil nu har været den syntetiske kemi's legeplads." I tekniske termer, undersøgelsen viser microcin J25 lasso peptider omdannet til en [2]catenan, en rotaxan, en [c2]daisy chain og en dobbelt-lasso makrocykel.
 Varme artikler
Varme artikler
-
 Ny potentiel kræftbehandling ved hjælp af mikrobølger til målretning mod dybe tumorerDen nye metode. Kredit:UTA Fysikere ved University of Texas i Arlington har vist, at brug af mikrobølger til at aktivere lysfølsomme nanopartikler producerer vævsopvarmningseffekter, der i sidste
Ny potentiel kræftbehandling ved hjælp af mikrobølger til målretning mod dybe tumorerDen nye metode. Kredit:UTA Fysikere ved University of Texas i Arlington har vist, at brug af mikrobølger til at aktivere lysfølsomme nanopartikler producerer vævsopvarmningseffekter, der i sidste -
 Arrays af små koniske spidser, der skubber ioniserede materialer ud, kunne fremstille enheder i nan…Til venstre er en tæt række af elektrospray-emittere (1, 900 emittere i 1 kvadratcentimeter). Til højre er et nærbillede af en enkelt sender, dækket af en skov af kulstofnanorør. Kredit:Journal of Mic
Arrays af små koniske spidser, der skubber ioniserede materialer ud, kunne fremstille enheder i nan…Til venstre er en tæt række af elektrospray-emittere (1, 900 emittere i 1 kvadratcentimeter). Til højre er et nærbillede af en enkelt sender, dækket af en skov af kulstofnanorør. Kredit:Journal of Mic -
 Teknik kunne producere stærk, modstandsdygtige nanofibre til mange applikationerNye ultrafine fibre skabt af MIT-teamet ses i et Scanning Electron Microscope (SEM) -billede. Kredit:Massachusetts Institute of Technology Forskere ved MIT har udviklet en proces, der kan producer
Teknik kunne producere stærk, modstandsdygtige nanofibre til mange applikationerNye ultrafine fibre skabt af MIT-teamet ses i et Scanning Electron Microscope (SEM) -billede. Kredit:Massachusetts Institute of Technology Forskere ved MIT har udviklet en proces, der kan producer -
 Neuroner i rygmarvsskader forbindes igen in vivo via carbon nanorørsvampeFra venstre mod højre:billede af en sund rygrad (kontrol); billede af en skadet rygrad uden implantat; billede af en skadet rygrad, hvori det biokompatible nanomateriale er blevet implanteret, og hvor
Neuroner i rygmarvsskader forbindes igen in vivo via carbon nanorørsvampeFra venstre mod højre:billede af en sund rygrad (kontrol); billede af en skadet rygrad uden implantat; billede af en skadet rygrad, hvori det biokompatible nanomateriale er blevet implanteret, og hvor
- Hvordan påvirker højden vejret?
- Hvilken glacial flod afslører om det grønlandske islag
- Astronauter udskifter gamle batterier i 1. af 5 rumvandringer
- MOF'er kan registrere og sortere besværlige gasser
- Klimamønstre i det nordlige Stillehav påvirker El Nino-forekomster
- Neutroner samler et 40-årigt puslespil bag den mystiske magnetisme af jernjod


