Inflydelse af nanopartikler, omgivende ioner på dannelsen af β-arkstruktur i amyloid β-proteiner
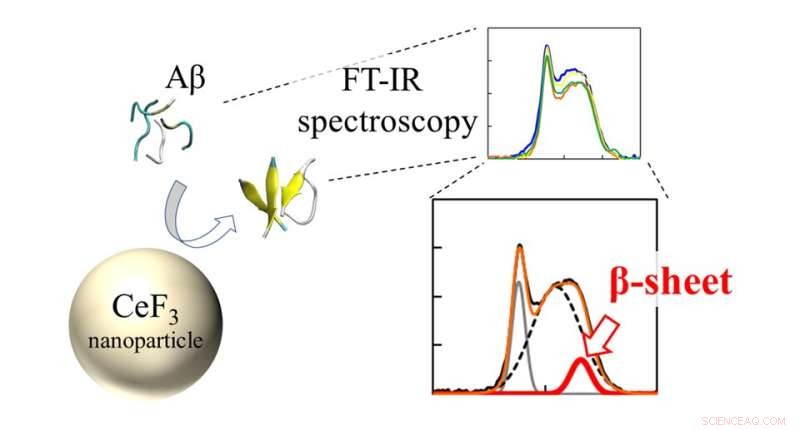
Infrarøde (FT-IR) spektre og β-sheet ratio af Aβ peptider interageret med CeF3 NP'er. Effekten af CeF3 nanopartikler på amyloid beta-proteinstruktur måles direkte med FT-IR spektroskopi. Dannelsen af sekundær struktur viser sig som en funktion i IR-spektret. Kredit:Masakazu Umezawa / Tokyo University of Science, Licenstype:CC BY 4.0
Proteinfunktion og aktivitet bestemmes af både deres samling og sekundære struktur. Abnormiteter relateret til enten proteinaggregation eller sekundær struktur kan føre til neurodegenerative sygdomme. I en ny undersøgelse afslører et internationalt forskerhold, hvordan fluorid-nanopartikler, materialer, der bruges til in vivo-billeddannelse, påvirker samlingen og strukturen af amyloid-β-proteinet. Deres resultater er et skridt mod bedre behandling og forebyggelse af neurologiske lidelser som Alzheimers sygdom.
Selvsamling, eller sammenslutningen af individuelle enheder af et materiale til ordnede strukturer eller mønstre, er et fænomen af stor forskningsinteresse for materialeforskere. Et fremtrædende eksempel på selvsamling kommer fra selvsamling af proteiner i biologiske systemer. Funktionen og aktiviteten af proteiner er styret af deres samlingstilstand. Derudover spiller proteinets "sekundære struktur", karakteriseret ved dets foldning til strukturer, såsom et β-ark, også en rolle. Faktisk kan abnormiteter i proteinets sekundære strukturer eller deres samling føre til forskellige neurodegenerative sygdomme, herunder Alzheimers sygdom.
Nanopartikler (NP'er) tilbyder en lovende vej til behandling og forebyggelse af sådanne sygdomme ved at tillade en kontrolleret og målrettet lægemiddellevering. Derudover bruges uorganiske NP'er, såsom fluorid-NP'er, i hjernebilleddannelsesapplikationer. Sammenlignet med organiske NP'er anses uorganiske NP'er for at være en bedre kandidat til at udvikle højfunktionelle materialer. Men der er stor bekymring med hensyn til deres biotoksicitet. Mens deres interaktioner med bioproteiner er blevet undersøgt, er mekanismen bag disse interaktioner ikke godt forstået.
Et internationalt hold af videnskabsmænd fra Tokyo University of Science (TUS) i Japan og Nazarbayev University i Kasakhstan har nu behandlet dette problem. I deres undersøgelse, som blev gjort tilgængelig online den 2. juni 2022 og blev offentliggjort i tidsskriftet ACS Applied Bio Materials den 20. juni 2022 undersøgte holdet en sektion af amyloid β-peptidet (et protein fundet i plaques, der dannes i hjernen hos patienter med Alzheimers sygdom) i en opløsning med fluoridkeramik (CeF3 ) NP'er. Undersøgelsen blev ledet af juniorlektor Masakazu Umezawa og omfattede bidrag fra Mr. Naoya Sakaguchi fra TUS og adjunkter Mehdi Amouei Torkmahalleh og Dhawal Shah fra Nazarbayev University.
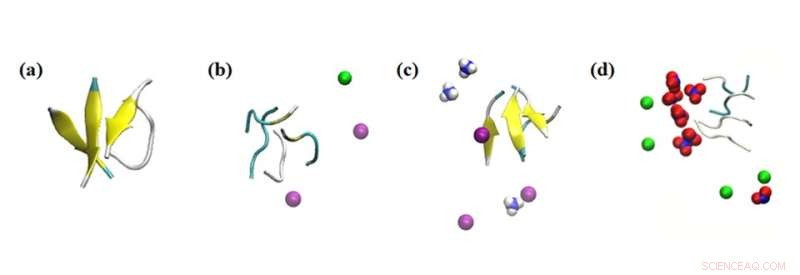
Simuleringssnapshots af peptidaggregatets interaktioner med forskellige ioner. Simuleringsresultater af virkningen af ioner inden for 0,1 nm på peptiderne i de undersøgte systemer:(a) intet salt, (b) 0,15 M NaCl, (c) 0,15 M NH4Cl og (d) 0,15 M NaNO3. Farve:beta ark =gul; Na+ =grøn; NH4+ =blå og hvid; Cl- =lilla; og NO3− =blå og rød. Kredit:Masakazu Umezawa / Tokyo University of Science, Licenstype:CC BY 4.0
Holdet brugte en teknik kaldet "Fourier transform infrarød spektroskopi" (FTIR) til direkte at overvåge effekten af NP-overfladen på peptidbindingerne. "Vi fandt ud af, at nær nanopartikeloverfladen er der større sandsynlighed for, at peptider danner β-sheets. Dette kommer som en effekt af hydrofobicitet. De dele af peptidet, der frastødes af vandopløsningen, klæber til nanopartiklerne, og danner lettere aggregater." forklarer Dr. Umezawa.
Derudover undersøgte holdet effekten af andre omgivende ioner i opløsningen. "Det, vi fandt, var meget overraskende. Selv uden nanopartiklerne påvirkede miljøet hastigheden af sekundær strukturdannelse," siger Dr. Umezawa, "Denne effekt, som er et resultat af en kombination af elektrostatisk interaktion og hydrogenbinding, blev overdrevet ved tilføjelse af nanopartikler. Med et omhyggeligt valg af ioner og nanopartikler kan β-sheetdannelsen enten undertrykkes eller fremmes. Dette indebærer, at processen kan kontrolleres og konstrueres til at udrydde negative virkninger."
De eksperimentelle resultater blev suppleret med simuleringer af molekylær dynamik udført af Nazarbayev University-teamet. Dette hjalp til gengæld med at designe og guide eksperimenterne samt give indsigt i resultaterne.
Med denne dybere forståelse af interaktionen mellem proteiner og NP'er baner undersøgelsen vejen for kontrollerede proteinfoldningsprocesser. Med en sådan kontrol kunne enhver proteindeformation elimineres, og positive interaktioner og strukturelle ændringer kunne fremmes. Dette kan føre til en bedre forebyggelses- og behandlingsprotokol for Alzheimers sygdom og i sidste ende til en bedre livskvalitet for ældre voksne. + Udforsk yderligere
Afkodning af proteinsamlingsdynamik med kunstige proteinnåle
 Varme artikler
Varme artikler
-
 Ikke længere kun en tilskuer, siliciumoxid kommer ind i elektronikken på computerchipsComputerchips indeholder siliciumoxid, et stof, som videnskabsmænd engang betragtede som en ren isolator, men som nu ser ud til at være en aktiv del af elektroniske processer, der driver mobiltelefone
Ikke længere kun en tilskuer, siliciumoxid kommer ind i elektronikken på computerchipsComputerchips indeholder siliciumoxid, et stof, som videnskabsmænd engang betragtede som en ren isolator, men som nu ser ud til at være en aktiv del af elektroniske processer, der driver mobiltelefone -
 Fremhæv:Nanoskala piezorespons af ferroelektriske domænerDe første grundlæggende undersøgelser af afhængigheden af ferroelektrisk domænekonfiguration og omskiftningsadfærd på formen af epitaksiale BiFeO3 (BFO) nanostrukturer er blevet rapporteret af bru
Fremhæv:Nanoskala piezorespons af ferroelektriske domænerDe første grundlæggende undersøgelser af afhængigheden af ferroelektrisk domænekonfiguration og omskiftningsadfærd på formen af epitaksiale BiFeO3 (BFO) nanostrukturer er blevet rapporteret af bru -
 Magneto-termisk billeddannelse bringer synkrotronkapaciteter til laboratorietKredit:ACS Kommer snart til en laboratoriebordplade nær dig:en metode til magneto-termisk billeddannelse, der tilbyder nanoskala og picosecond-opløsning, som tidligere kun var tilgængelig i synkro
Magneto-termisk billeddannelse bringer synkrotronkapaciteter til laboratorietKredit:ACS Kommer snart til en laboratoriebordplade nær dig:en metode til magneto-termisk billeddannelse, der tilbyder nanoskala og picosecond-opløsning, som tidligere kun var tilgængelig i synkro -
 Beviser nanopartikler i solcremeprodukterNår en nanopartikel trænger ind i plasma, der opstår et diskontinuerligt signal. Signalintensiteten korrelerer med partikelstørrelsen. Kredit:Fraunhofer IGB Masser af kosmetik som solcreme indehol
Beviser nanopartikler i solcremeprodukterNår en nanopartikel trænger ind i plasma, der opstår et diskontinuerligt signal. Signalintensiteten korrelerer med partikelstørrelsen. Kredit:Fraunhofer IGB Masser af kosmetik som solcreme indehol
- Nye spor om mørkt stof fra de mørkeste galakser
- Kviksølv topper 45 grader i Frankrig, mens en dødelig hedebølge hærger Europa
- Knækker mysteriet om naturens hårdeste materiale
- En lille bid til manden:3D-printeren laver kød i rummet
- Sporing af strømmen af kvanteinformation
- Ny testmetode til at standardisere immunologisk evaluering af nukleinsyrenanopartikler


