Nanobiotika:Ny maskinlæringsmodel forudsiger, hvordan nanopartikler interagerer med proteiner
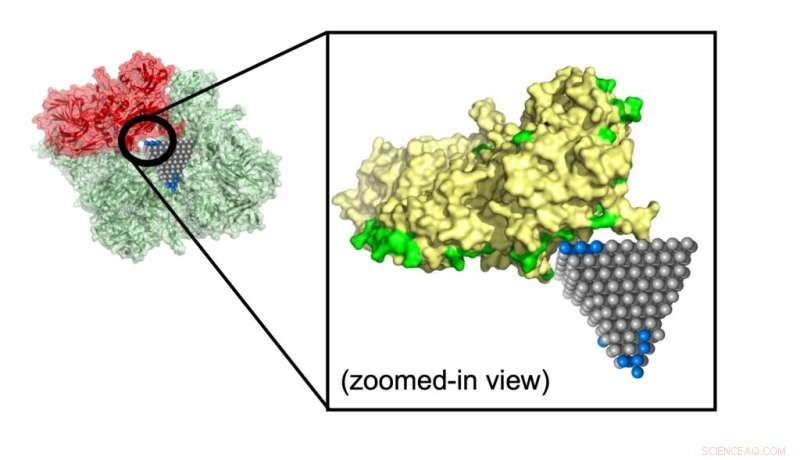
Modellen forudsagde, hvordan en zinkoxid-nanopyramid afbryder et protein, der bidrager til metabolisme i MRSA (methicillin-resistent Staphylococcus aureus), en almindelig stamme, der forårsager antibiotika-resistente infektioner. Kredit:Minjeong Cha og Emine Sumeyra Turali Emre, Kotov Lab
Med antibiotika-resistente infektioner i stigning og en konstant forvandlende pandemisk virus, er det let at se, hvorfor forskere ønsker at være i stand til at designe konstruerede nanopartikler, der kan lukke ned for disse infektioner.
En ny maskinlæringsmodel, der forudsiger interaktioner mellem nanopartikler og proteiner, udviklet ved University of Michigan, bringer os et skridt tættere på denne virkelighed.
"Vi har omtænkt nanopartikler til at være mere end blot lægemiddelleveringsmidler. Vi betragter dem som aktive lægemidler i sig selv," sagde J. Scott VanEpps, assisterende professor i akutmedicin og forfatter til undersøgelsen i Nature Computational Videnskab .
At opdage stoffer er en langsom og uforudsigelig proces, og derfor er så mange antibiotika variationer af et tidligere lægemiddel. Lægemiddeludviklere vil gerne designe medicin, der kan angribe bakterier og vira på måder, som de vælger, ved at drage fordel af de "lås og nøgle"-mekanismer, der dominerer interaktioner mellem biologiske molekyler. Men det var uklart, hvordan man skiftede fra den abstrakte idé om at bruge nanopartikler til at forstyrre infektioner til praktisk implementering af konceptet.
"Ved at anvende matematiske metoder til protein-protein-interaktioner har vi strømlinet designet af nanopartikler, der efterligner et af proteinerne i disse par," sagde Nicholas Kotov, professor ved Irving Langmuir Distinguished University i kemividenskab og ingeniørvidenskab og tilsvarende forfatter til undersøgelsen. .
"Nanopartikler er mere stabile end biomolekyler og kan føre til helt nye klasser af antibakterielle og antivirale midler."
Den nye maskinlæringsalgoritme sammenligner nanopartikler med proteiner ved at bruge tre forskellige måder at beskrive dem på. Mens den første var en konventionel kemisk beskrivelse, viste de to, der vedrørte struktur, sig at være vigtigst for at kunne forudsige, om en nanopartikel ville være et lås-og-nøgle-match med et specifikt protein.
Mellem dem fangede disse to strukturelle beskrivelser proteinets komplekse overflade, og hvordan det kan rekonfigurere sig selv for at muliggøre lås-og-nøgle-pasninger. Dette inkluderer lommer, som en nanopartikel kunne passe ind i, sammen med den størrelse en sådan nanopartikel skal have. Beskrivelserne inkluderede også chiralitet, en drejning med uret eller mod uret, der er vigtig for at forudsige, hvordan et protein og en nanopartikel vil låse sig.
"Der er mange proteiner uden for og inde i bakterier, som vi kan målrette mod. Vi kan bruge denne model som en første screening for at opdage, hvilke nanopartikler der vil binde sig til hvilke proteiner," siger Emine Sumeyra Turali Emre, en postdoc-forsker i kemiteknik og co-first. forfatter til papiret sammen med Minjeong Cha, en ph.d. studerende i materialevidenskab og teknik.
Emre og Cha forklarede, at forskere kunne følge op på kampe identificeret af deres algoritme med mere detaljerede simuleringer og eksperimenter. Et sådant match kunne stoppe spredningen af MRSA, en almindelig antibiotika-resistent stamme, ved hjælp af zinkoxid-nanopyramider, der blokerer metaboliske enzymer i bakterierne.
"Maskinlæringsalgoritmer som vores vil give et designværktøj til nanopartikler, der kan bruges i mange biologiske processer. Hæmning af virussen, der forårsager COVID-19, er et godt eksempel," sagde Cha. "Vi kan bruge denne algoritme til effektivt at designe nanopartikler, der har bredspektret antiviral aktivitet mod alle varianter."
Dette gennembrud blev muliggjort af Blue Sky Initiative på U-M College of Engineering, som ydede støtte til det tværfaglige team, der udførte den grundlæggende udforskning af, om en maskinlæringstilgang kunne være effektiv, når data om nanopartiklers biologiske aktivitet er så sparsomme.
"Kernen i Blue Sky-ideen er præcis, hvad dette arbejde dækker:at finde en måde at repræsentere proteiner og nanopartikler i en samlet tilgang til at forstå og designe nye klasser af lægemidler, der har flere måder at arbejde mod bakterier på," sagde Angela Violi, en Arthur F. Thurnau Professor, professor i maskinteknik og leder af nanobiotika Blue Sky-projektet.
Samarbejdspartnere ved University of California, Los Angeles bidrog også til maskinlæringsalgoritmen. + Udforsk yderligere
Nyt værktøj tillader hidtil uset modellering af magnetiske nanopartikler
 Varme artikler
Varme artikler
-
 Papirbaseret trådløs sensor fra CNT kan hjælpe med at opdage eksplosive enhederKrishna Naishadham, venstre, og Xiaojuan (Judy) Song viser to typer trådløse ammoniakfølende prototype-enheder. (Georgia Tech Foto:Gary Meek) (PhysOrg.com) - Forskere ved Georgia Institute of Tech
Papirbaseret trådløs sensor fra CNT kan hjælpe med at opdage eksplosive enhederKrishna Naishadham, venstre, og Xiaojuan (Judy) Song viser to typer trådløse ammoniakfølende prototype-enheder. (Georgia Tech Foto:Gary Meek) (PhysOrg.com) - Forskere ved Georgia Institute of Tech -
 Kemikere bruger DNA til at bygge verdens mindste antenneSom en tovejsradio, der både kan modtage og transmittere radiobølger, modtager den fluorescerende nanoantenne designet af Alexis Vallée-Bélisle og hans team lys i én farve og afhængigt af proteinbevæg
Kemikere bruger DNA til at bygge verdens mindste antenneSom en tovejsradio, der både kan modtage og transmittere radiobølger, modtager den fluorescerende nanoantenne designet af Alexis Vallée-Bélisle og hans team lys i én farve og afhængigt af proteinbevæg -
 Vintræ-lignende CNT-arkitekturerHierarkiske vinstokke-trælignende kulstof-nanorørarkitekturer sammensat af vinlignende enkeltvæggede carbon-nanorør, der vikles rundt om de trælignende multi-wallede carbon-nanorør, fremstilles gennem
Vintræ-lignende CNT-arkitekturerHierarkiske vinstokke-trælignende kulstof-nanorørarkitekturer sammensat af vinlignende enkeltvæggede carbon-nanorør, der vikles rundt om de trælignende multi-wallede carbon-nanorør, fremstilles gennem -
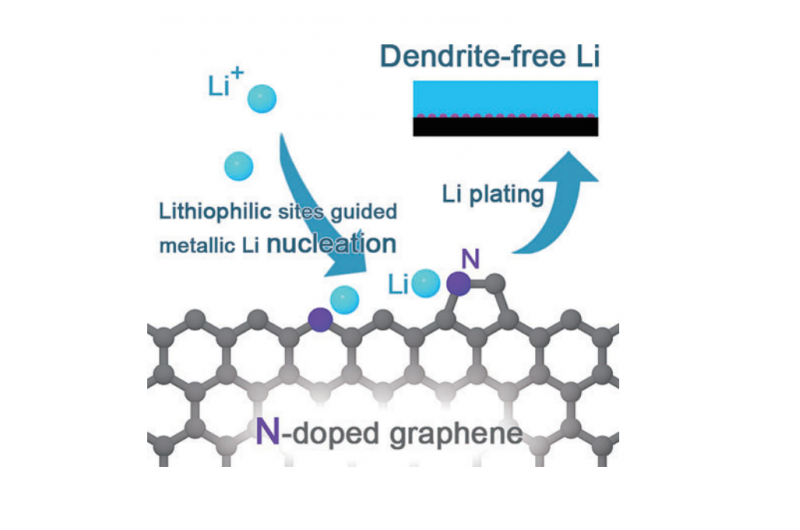 Dendritfri litiummetalanoder ved hjælp af N-doteret grafenmatrixKredit:Tsinghua University For nylig, Forskere ved Tsinghua University har foreslået en nitrogendoperet grafenmatrix med tæt og ensartet fordelt litiofile funktionelle grupper til dendritfrie liti
Dendritfri litiummetalanoder ved hjælp af N-doteret grafenmatrixKredit:Tsinghua University For nylig, Forskere ved Tsinghua University har foreslået en nitrogendoperet grafenmatrix med tæt og ensartet fordelt litiofile funktionelle grupper til dendritfrie liti
- Skove kan miste evnen til at beskytte sig mod ekstreme klimaændringer, undersøgelse finder
- Registrering af små nano -mængder i miljøprøver
- Bæredygtige biosyntetiske transparente film udviklet til plasterstatning
- Opkald om hjælp i hjemmet steg med 20 % under pandemien
- Hvad er en hydraulisk power pack?
- Playboy forlader Facebook på grund af skandale om databeskyttelse


