For første gang blev DNA og proteiner registreret af de novo-designede nanopore
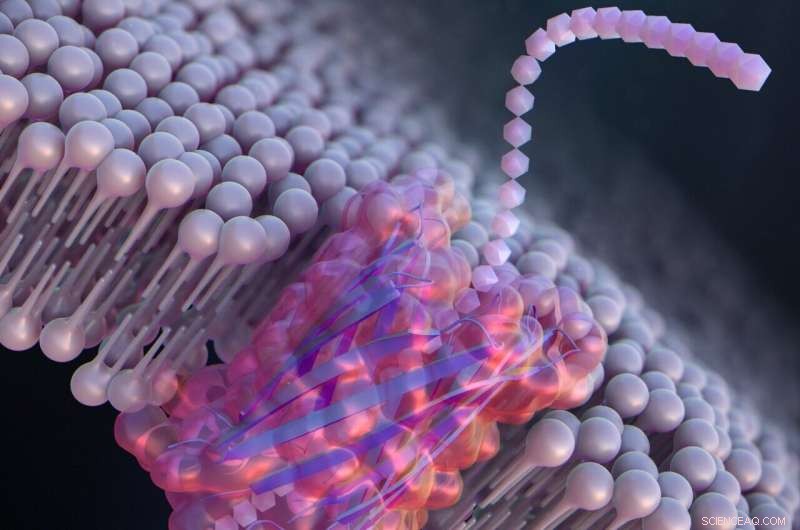
De novo design af en nanopore til enkelt-molekyle detektion, der inkorporerer et β-hårnåle peptid. Kredit:Ryuji Kawano, Tokyo University of Agriculture and Technology
Forskere i Japan har designet de første bottom-up-designede peptider, bestående af kæder af aminosyrer, som kan danne kunstige nanoporer for at identificere og muliggøre enkeltmolekyle-sortering af genetisk materiale i en lipidmembran.
Biologiske nanoporer er generelt kanaler fremstillet af poredannende proteiner, som kan detektere specifikke molekyler, men sådanne naturlige kanaler er svære at identificere, hvilket begrænser foreslåede anvendelser til billig, hurtig DNA-sekventering, små molekyle detektion og mere.
"Nanopore sensing er et kraftfuldt værktøj til etiketfri, enkelt-molekyle detektion," sagde den tilsvarende forfatter Ryuji Kawano, professor ved Tokyo University of Agriculture and Technology (TUAT) i Japan. "Dette er første gang, at DNA og polypeptider blev registreret ved hjælp af en de novo-designet nanopore."
De offentliggjorde deres resultater den 22. november i Nature Nanotechnology .
De novo-designede nanoporer er bygget "fra bunden", ifølge Kawano, og har potentialet til at efterligne naturlige proteiner og deres evne til at detektere specifikke proteiner. Det er afgørende, sagde Kawano, at de også kan konstrueres til at fungere som kunstige molekylære maskiner, der er i stand til at detektere et meget bredere udvalg af molekyler – hvilket kan hjælpe med at belyse sammenhængen mellem struktur og funktion i målproteiner.
"Den foldede struktur af proteiner bestemmes af deres lineære polypeptidsekvens og giver anledning til specifik proteinfunktionalitet," sagde Kawano og bemærkede, at alle proteiner har en unik struktur og størrelse. "Den unikke primære struktur er resultatet af strukturel evolution, såsom mutation og udvælgelse af aminosyrerester over tid. At afsløre forholdet mellem denne primære information og proteinstruktur er et af videnskabens ultimative mål."
For at udvikle store syntetiske nanoporer, der bedre kan detektere og identificere molekyler til praktiske anvendelser, designede Kawano og teamet et peptid kaldet SV28. Med to arme af aminosyrer bøjet i en skarp vinkel og specifikke ladninger ved endestationen, kan orienteringen af det hårnåleformede peptid styres præcist ved at påføre en spænding. Peptidet kan samles til at danne nanopore-strukturer, der varierer i størrelse fra 1,7 til 6,3 nanometer, velegnet til påvisning af DNA-molekyler.
Forskerne modificerede også SV28 ved at tilføje en mutation, der får peptidstrukturen til at bøje og vride på bestemte måder. Det resulterende peptid dannede jævnt spredte porer på hver 1,7 nanometer, der var i stand til at detektere en enkelt polypeptidkæde – eller halvdelen af et protein.
Denne præstation kunne anvendes til at lette forståelsen af forholdet mellem proteinstruktur og funktion.
Til de næste trin planlægger teamet at designe forskellige peptider og proteiner til at konstruere forskellige typer nanoporer for at hjælpe med peptidsekventering, fungere som molekylære robotter og mere. + Udforsk yderligere
Scanning af et enkelt protein, én aminosyre ad gangen
Sidste artikelBjærgning af sjældne jordarter fra elektronisk affald
Næste artikelBrug af princippet bag kafferingeffekt i kvantepunkter
 Varme artikler
Varme artikler
-
 Forskere tager et spin på magnetoresistiv RAMForstøvningsteknikken er blevet brugt i vid udstrækning til tyndfilmaflejring. Under sprøjtepistolerne, en otte-tommers oblat med mønstret enhed fremstillet ved aflejring, fotolitografi, ætsning, osv.
Forskere tager et spin på magnetoresistiv RAMForstøvningsteknikken er blevet brugt i vid udstrækning til tyndfilmaflejring. Under sprøjtepistolerne, en otte-tommers oblat med mønstret enhed fremstillet ved aflejring, fotolitografi, ætsning, osv. -
 Let berøring gør nanorør lysere (med video)Enkeltvæggede kulstofnanorør behandlet med ozon inkorporerer oxygenatomer, der forskyder og intensiverer nanorørenes nær-infrarøde fluorescensemission. Opdagelsen af Rice University-forskere skulle
Let berøring gør nanorør lysere (med video)Enkeltvæggede kulstofnanorør behandlet med ozon inkorporerer oxygenatomer, der forskyder og intensiverer nanorørenes nær-infrarøde fluorescensemission. Opdagelsen af Rice University-forskere skulle -
 Unikke egenskaber ved 2-D materialer og metaller dyrket på kulstofbelagte overfladerKredit:Ames Laboratory Todimensionelle materialer er lidt af et tankevækkende koncept. Mennesker lever i en tredimensionel verden, trods alt, hvor alt observeret i vores naturlige verden har højde
Unikke egenskaber ved 2-D materialer og metaller dyrket på kulstofbelagte overfladerKredit:Ames Laboratory Todimensionelle materialer er lidt af et tankevækkende koncept. Mennesker lever i en tredimensionel verden, trods alt, hvor alt observeret i vores naturlige verden har højde -
 Bøjende fingre til mikrorobotik:Forskere skaber en kraftfuld, mikroskala aktuatorEn enkelt aktuator krøller og udvider sig, når temperaturen ændres med 15 grader Celsius, som vist i dette mikrofotografi. Til højre, en håndfladelignende konfiguration af aktuatorer, der alle krøller
Bøjende fingre til mikrorobotik:Forskere skaber en kraftfuld, mikroskala aktuatorEn enkelt aktuator krøller og udvider sig, når temperaturen ændres med 15 grader Celsius, som vist i dette mikrofotografi. Til højre, en håndfladelignende konfiguration af aktuatorer, der alle krøller
- Forskere bruger varme Jupiter-data til at mine exoplanetkemi
- Undersøgelse af dynamikken i fotoemission
- Grafentilsætningsstoffer viser en ny måde at kontrollere strukturen af organiske krystaller på
- Forskere skaber metode til mere følsomme elektrokemiske sensorer
- Biologisk nedbrydelige broer:Levende strukturer, der reagerer på miljøet
- 2D materialer kombinerer, bliver polariseret og giver anledning til fotovoltaisk effekt


