Ferritin-baseret nanomedicin udviklet til målrettet leukæmibehandling
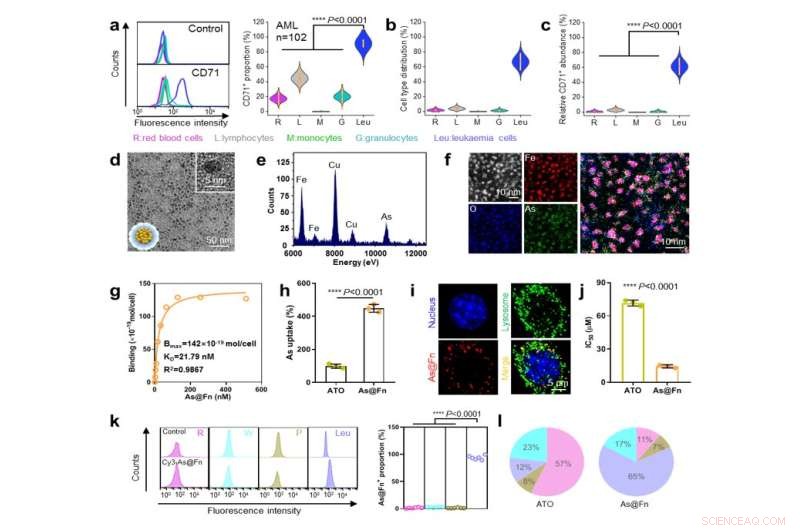
CD71-ekspression på leukæmiceller, As@Fn-konstruktion og målretningsevneanalyse. Kredit:IPE
Forskere fra Institute of Process Engineering (IPE) ved det kinesiske videnskabsakademi, Peking University og Zhujiang Hospital fra Southern Medical University har udviklet en ferritin (Fn)-baseret nanomedicin til målrettet levering af arsen (As) og effektiv terapi mod forskelligartet leukæmi typer.
Undersøgelsen blev offentliggjort i Nature Nanotechnology den 25. oktober.
Leukæmi er en alvorlig trussel mod menneskers sundhed, med dårlige overlevelsesrater for både voksne og børn. I klinikken er kemoterapi stadig den vigtigste terapeutiske modalitet for alle typer leukæmi og inducerer uundgåeligt off-target distribution og toksiske bivirkninger.
Målrettet levering af kemoterapeutiske lægemidler til leukæmiceller kan lindre toksiske bivirkninger og forbedre terapeutiske virkninger. Adskillige nye mål er blevet identificeret på leukæmiceller, men deres ekspressionsegenskaber varierer meget for forskellige typer og forløb af leukæmi.
Gennem screening af et stort antal kliniske prøver bekræftede forskere, at patienter med forskellige former for leukæmi havde stabil og stærk ekspression af CD71. "CD71 kan bruges som et nyt og pålideligt mål for udviklingen af anti-leukæmi præcisionsterapier," sagde prof. Li Yuhua fra Zhujiang Hospital.
Som CD71-liganden har Fn en unik kvaternær struktur og indre hulrum, som er gunstige for lægemiddelakkommodation. Ved hjælp af en ferri-medieret koordinationsproces blev trivalent As (AsIII), den medicinske form af det kemoterapeutiske lægemiddel arsentrioxid (ATO), effektivt indlæst i Fn.
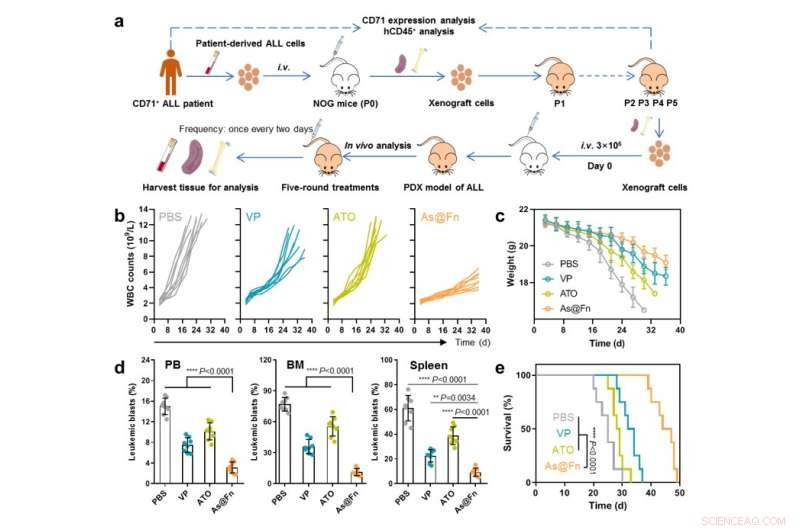
Potent anti-leukæmi-aktivitet af As@Fn i patient-afledt xenograft-model. Kredit:IPE
"Ladeindholdet er ~200 As i hver Fn, og As matcher den kendte klinisk effektive valenstilstand for den godkendte ATO," sagde prof. Ma Ding fra Peking University.
As@Fn-formuleringen bibeholdt en stærk kapacitet til at binde til forskellige typer leukæmiceller. Efter internalisering ville AsIII så blive frigivet i det sure lysosom.
"Vi er glade for at observere, at vores As@Fn nanomedicin forbedrede As-akkumuleringen i leukæmiceller både in vitro og in vivo," sagde prof. Wei Wei fra IPE. "Sådan måladfærd er gunstig til at forbedre drabseffekten på leukæmiceller og samtidig reducere toksiciteten for normalt væv."
Med hensyn til terapeutisk effektivitet udkonkurrerede As@Fn guldstandarden i forskellige cellelinjeafledte xenograftmodeller såvel som i en patientafledt xenograftmodel.
"Denne nanomedicin udvidede ikke kun det terapeutiske vindue af As, men udvidede også anvendelsen til flere typer leukæmi," sagde prof. Ma Guanghui fra IPE. "I betragtning af at Fn er et endogent protein, og ATO er blevet godkendt til klinisk anti-leukæmibrug, har vores nanomedicin potentiale til klinisk oversættelse."
En peer reviewer fra Nature Nanotechnology sagde:"Samlet set var undersøgelsen godt udført og kontrolleret med en betydelig mængde af in vitro og in vivo data for at understøtte, at den nyudviklede As@Fn som en ny ferritin-baseret As nanomedicin er effektiv til at behandle forskelligartet human leukæmi." + Udforsk yderligere
Forskere udvikler ny præcis terapeutisk leukæmivaccine
 Varme artikler
Varme artikler
-
 Forskere observerer interband kollektive excitationer i snoet dobbeltlagsgrafenKunstnerisk visualisering af interband kollektive excitationer lanceret og udbredt i snoet dobbeltlagsgrafen. Kredit:Matteo Ceccanti. Snoet dobbeltlagsgrafen er et kulstofbaseret, todimensionelt (2
Forskere observerer interband kollektive excitationer i snoet dobbeltlagsgrafenKunstnerisk visualisering af interband kollektive excitationer lanceret og udbredt i snoet dobbeltlagsgrafen. Kredit:Matteo Ceccanti. Snoet dobbeltlagsgrafen er et kulstofbaseret, todimensionelt (2 -
 Team demonstrerer solvandsspaltningsteknologiRice University forskere har demonstreret en effektiv ny måde at fange energien fra sollys og omdanne den til ren, vedvarende energi ved at spalte vandmolekyler. Kredit:I. Thomann/Rice University
Team demonstrerer solvandsspaltningsteknologiRice University forskere har demonstreret en effektiv ny måde at fange energien fra sollys og omdanne den til ren, vedvarende energi ved at spalte vandmolekyler. Kredit:I. Thomann/Rice University -
 Gadget geniMønstre af to gigantiske overfladeaktive prøver i tyndfilmstilstand. Kilde:Proceedings of the National Academy of Sciences. University of Akron forskere har udviklet nye materialer, der fungerer p
Gadget geniMønstre af to gigantiske overfladeaktive prøver i tyndfilmstilstand. Kilde:Proceedings of the National Academy of Sciences. University of Akron forskere har udviklet nye materialer, der fungerer p -
 Fanget lys kredser i et spændende materialeMønstre af kredsende lys forudsagt for sfæroider af sekskantet bornitrid belyst med en dipolkilde lige over deres nordpoler. Disse er plots i falske farver af forudsagte hot spots af forbedrede elektr
Fanget lys kredser i et spændende materialeMønstre af kredsende lys forudsagt for sfæroider af sekskantet bornitrid belyst med en dipolkilde lige over deres nordpoler. Disse er plots i falske farver af forudsagte hot spots af forbedrede elektr
- Datalagring ved hjælp af individuelle molekyler
- Sådan dyrker du Borax Crystals
- Mulige irreversible ændringer af delsystemer, inden vi når klimaet for klimaændringer
- Ny test måler nøgleegenskaber ved polymertynde film og membraner
- Ny brineprocessor øger vandgenanvendelse på International Space Station
- Mikrobølgeovn nøgle til selvsamlingsproces, der opfylder halvlederindustriens behov


