Ny tilgang bruger tilslørede proteiner til at levere kræft-dræbende terapi til celler
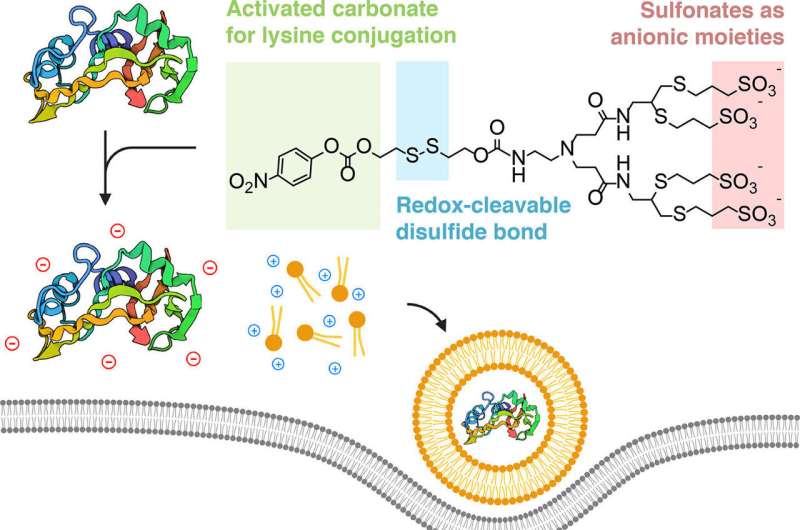
Et tværfagligt samarbejde har designet en måde at "kappe" proteiner på, så de kan fanges af lipid-nanopartikler, som er beslægtet med bittesmå bobler af fedt. Disse bobler er små nok til at snige deres skjulte last ind i levende celler, hvor proteinerne afdækkes og udøver deres terapeutiske effekt.
Den generaliserbare teknik kan føre til genbrug af tusindvis af kommercielle proteinprodukter, inklusive antistoffer, til biologisk forskning og terapeutiske anvendelser.
Gruppens papir, "Bioreversible Anionic Cloaking Enables Intracellular Protein Delivery with Ionizable Lipid Nanoparticles," offentliggjort 14. maj i ACS Central Science . Hovedforfatteren er ph.d.-studerende Azmain Alamgir, som arbejder i laboratorierne hos papirets medseniorforfattere, Chris Alabi, lektor i kemisk og biomolekylær ingeniørvidenskab i Cornell Engineering, og Matt DeLisa, William L. Lewis professor i ingeniørvidenskab og direktør. fra Cornell Institute of Biotechnology.
Projektet startede med et enestående mål:at kombinere DeLisa-gruppens ekspertise i at designe proteinbaserede lægemidler med Alabi-laboratoriets fokus på intracellulær levering af biologiske lægemidler.
For at nogle lægemidler kan påvirke en celles biologi og i sidste ende behandle sygdom, skal de komme ind i cellen og nå et bestemt rum. Dette svarer til at reparere et ødelagt rør i et hjem:VVS-installatøren skal have adgang til et bestemt rum for at reparere lækagen.
Proteinbaserede terapier har mange dyder - de kan have mere specifikke virkninger, med lavere toksicitet og nedsat immunrespons - men nem levering er ikke en af dem. Proteiner er store og besværlige og diffunderer ikke frit ind i celler så let som små molekyler gør. Det er en af grundene til, at små molekyler er den dominerende kilde til lægemidler i den farmaceutiske industri:De kan let diffundere ind i celler uden et transportmiddel.
Gennem årene har DeLisas gruppe udviklet en bred vifte af interessante og potentielt effektive proteinlægemiddelkandidater. Desværre var den praktiske anvendelighed af disse proteiner begrænset af fraværet af en metode til intracellulær levering. Mens genterapi – en biomedicinsk teknologi, der kan producere en terapeutisk effekt ved at levere et gen til ekspression i målceller – var en mulighed, har metoden en broget historie på grund af sikkerhedsproblemer hos mennesker.
"Vi havde ledt efter en smart måde til effektivt at få vores konstruerede proteiner ind i celler, især i en translationel sammenhæng, der ikke kun ville fungere i laboratoriedyrkede celler, men som også ville være effektiv og sikker i dyremodeller og i sidste ende i mennesker ," sagde DeLisa.
"Da Azmain forbandt vores gruppe med Chris' gruppe, var en af ideerne, der dukkede op, hvorfor levere dette som en genterapi, når vi kunne levere det som et allerede fremstillet protein? Og så det gjorde os virkelig begejstrede."
Alabis laboratorium havde stået over for sine egne udfordringer. Mens holdet havde erfaring med at levere nukleinsyrer ind i celler ved hjælp af nanopartikler, sagde Alabi, at de endnu ikke havde fundet en måde at gøre det samme med "globular squishy bløde proteiner" på grund af laboratoriets begrænsede erfaring med at producere tilstrækkelige mængder af proteinerne til test.
"Vi så dette som en god bro mellem vores forskningsgrupper, for at skabe dette nye rum, som jeg ikke tror, at mange mennesker arbejdede på på det tidspunkt og gøre det på en måde, der kunne være skalerbar og virkningsfuld," sagde Alabi. .
Forskerne havde den brede idé at bruge en biokonjugationstilgang, der ville tillade proteinerne at blive indlæst i lipidnanopartikler, som dannes omkring nukleinsyrer. En stor fordel ved denne tilgang var, at lipid-nanopartikler var en nøglekomponent i de succesrige COVID-19-vacciner udviklet af Pfizer-BioNTech og Moderna.
"På det tidspunkt tog den teknologi virkelig fart," sagde Alamgir.
Disse vacciner virkede ved at levere en nyttelast i form af messenger-RNA, som er nukleinsyrer. Forskerne ville nu bruge det samme lipid-nanopartikel-leveringskoncept - de samme materialer endda - men med en proteinnyttelast. Tricket ville være at få proteiner til at ligne nukleinsyrer mere.
Forskerne fandt ud af, at de kunne opnå dette ved at "tildekke" proteinerne med en negativt ladet ion, så de ville slutte sig til de positivt ladede lipider elektrostatisk.
"Kruxet i vores strategi er konceptuelt meget simpelt," sagde Alamgir. "Vi tager proteiner og omformer specifikt deres overflader med negative ladninger, så de ligner nukleinsyrer og på samme måde kan samles til nanopartikler, når de formuleres med de karakteristiske lipider."
En vanskelighed, holdet stødte på, var, at de betingelser, hvorunder nukleinsyrer formuleres til at slutte sig til eller kompliceres med lipiderne, er ret barske – for hårde for proteiner.
"Vi var nødt til at bruge mildere forhold og en let modificeret formulering, hvor vi tilføjede ekstra lipider," sagde Alabi. "Så både fra proteinbiokonjugationssiden og også fra lipidsiden var vi nødt til at tilpasse formuleringen for at få dette til at fungere så godt, som det gør."
Holdet, som omfattede doktorstuderende og medforfatter Souvik Ghosal, demonstrerede med succes tilsløringsmetoden med lysin-reaktive sulfonerede forbindelser, dræber kræftceller med ribonuklease A og hæmmer tumorsignalering med monoklonale immunoglobulin G (IgG) antistoffer.
En yderligere fordel ved biokonjugationskemien, der bruges af holdet, er, at processen er reversibel. Det kemiske mærke, der tilsættes til proteinet, falder af, når det er kommet ind i cellens cytoplasma. Og fordi biokonjugationsmetoden er rettet mod lysin - en type aminosyre, der findes rigeligt i naturlige proteiner - kan teknikken replikeres for praktisk talt ethvert protein.
"Dette har potentiale til at tage en masse hyldevare-proteiner, der i øjeblikket er tilgængelige fra mange biovidenskabelige distributører og bioteknologivirksomheder, og genbruge dem til nye intracellulære applikationer," sagde Alamgir.
Flere oplysninger: Azmain Alamgir et al., Bioreversibel anionisk tilsløring muliggør intracellulær proteinlevering med ioniserbare lipidnanopartikler, ACS Central Science (2024). DOI:10.1021/acscentsci.4c00071
Journaloplysninger: ACS Central Science
Leveret af Cornell University
 Varme artikler
Varme artikler
-
 Forskere rapporterer om revolutionerende sensorer, der er i stand til at detektere kræftfremkaldend…Kredit:CC0 Public Domain Specialister ved National Research Nuclear University MEPhI og institutionelle samarbejdspartnere har foreslået et koncept med hypersensitive sensoriske transducere (Fouri
Forskere rapporterer om revolutionerende sensorer, der er i stand til at detektere kræftfremkaldend…Kredit:CC0 Public Domain Specialister ved National Research Nuclear University MEPhI og institutionelle samarbejdspartnere har foreslået et koncept med hypersensitive sensoriske transducere (Fouri -
 Imaging cellulære interiører ved hjælp af polymere nanopartiklerCeller kan optage polymer-nanopartikler, der indlejrer kvantepunkter dækket med cytokompatibel phospholipidpolymer og cellepenetrerende peptider. Kredit:Kazuhiko Ishihara, Weixin Chen, Yihua Liu, Yuri
Imaging cellulære interiører ved hjælp af polymere nanopartiklerCeller kan optage polymer-nanopartikler, der indlejrer kvantepunkter dækket med cytokompatibel phospholipidpolymer og cellepenetrerende peptider. Kredit:Kazuhiko Ishihara, Weixin Chen, Yihua Liu, Yuri -
 En ny og effektiv måde at skabe nanografen til strøm- og displayenhederKobbersonden kan manipulere stof på atomær skala. Kredit:© 2020 Shiotari et al. Nanografen er et materiale, der radikalt kan forbedre solceller, brændstofceller, LEDer og mere. Typisk, syntesen af
En ny og effektiv måde at skabe nanografen til strøm- og displayenhederKobbersonden kan manipulere stof på atomær skala. Kredit:© 2020 Shiotari et al. Nanografen er et materiale, der radikalt kan forbedre solceller, brændstofceller, LEDer og mere. Typisk, syntesen af -
 Ny, højstyrke og let perlemor-mimetisk materiale, der kan anvendes til store industrielle processerHelsinki University of Technology forskningsgruppe i samarbejde med VTT og Royal Institute of Technology, Finland, vis det første eksempel på letvægts, men mekanisk stærkt nanokompositmateriale, der e
Ny, højstyrke og let perlemor-mimetisk materiale, der kan anvendes til store industrielle processerHelsinki University of Technology forskningsgruppe i samarbejde med VTT og Royal Institute of Technology, Finland, vis det første eksempel på letvægts, men mekanisk stærkt nanokompositmateriale, der e
- Kortlivede lyskilder opdaget på himlen
- Sådan fremstilles en pladespiller til et Kids Science Project
- Kunne kvanteudsving i det tidlige univers forbedre skabelsen af massive galaksehobe?
- "How to Draw a Dendrogram
- Temperatureffekter på Density
- Google lover nye investeringer på $ 10 mia. I USA i 2020


