Sådan fungerer CRISPR Genredigering
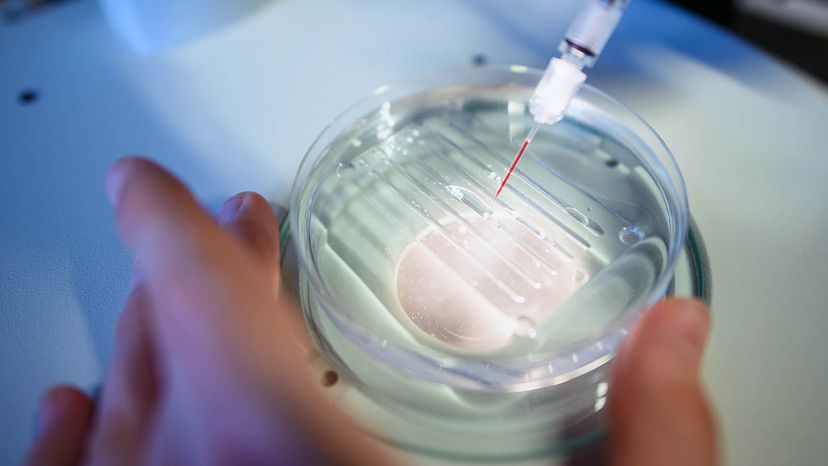 En forsker udfører en CRISPR/Cas9-proces på Max-Delbrueck-Center for Molekylær Medicin. Gregor Fischer/picture alliance via Getty Images
En forsker udfører en CRISPR/Cas9-proces på Max-Delbrueck-Center for Molekylær Medicin. Gregor Fischer/picture alliance via Getty Images Mutanter er seje, ret? X men, Teenage Mutant Ninja Turtles og superhelte på tværs af tegneserier og film overrasker os med de særlige kræfter, der er afledt af deres genetiske mutationer. Imidlertid, disse fiktive genetiske mutationer er lidt svære at finde - du skal have været bidt af en speciel edderkop eller udsat for et radioaktivt stof.
Men hvad nu hvis det ikke bare var let at foretage genetiske modifikationer, men hurtigt og billigt, også? Ville du villigt blive en mutant? Godt, med en teknologi kaldet CRISPR, du kan muligvis. Misforstå os ikke - CRISPR vil ikke gøre dig til en superhelt, men denne videnskabelige opdagelse har potentiale til at påvirke os i stor stil.
Forkortelse for klynges regelmæssigt mellem korte palindromiske gentagelser , CRISPR gør det muligt for os at flytte gener fra enhver levende ting til en anden, ændre DNA i de kommende generationer. Det giver os mulighed for at skære gener væk, der gør forfærdelige ting - som dem, der forårsager sygdom - og erstatte dem med DNA -segmenter, der er uskadelige.
På samme tid, CRISPR -teknologien er så kraftfuld, at mennesker kunne begynde at bruge den til mere end blot at helbrede sygdomme. Måske for at skabe flere sygdomsresistente afgrøder og husdyr. Eller for at lave gærmutanter, der producerer brændstoffer, som vi kan bruge til at drive vores biler. Vi begynder måske at blive virkelig kreative og lave designerbabyer, eller endda bruge teknologien til det onde-konstruere biovåben, der er artsspecifikke og tørrer hele arter af planetens overflade.
Efterhånden som vi lærer mere om, hvad MIT Technology Review kaldte "århundredets største biotekniske opdagelse, ”Vi skal også tænke over, hvornår vi skal bruge CRISPR, og hvordan det skal reguleres.
Indhold
- Bakterielle snigmordere
- Designer babyer, Invasive mutanter og DIY -biologi
Bakterielle snigmordere
Selvom CRISPR -teknologien er temmelig fantastisk, mennesker, der genetisk modificerer forskellige organismer, er ikke noget nyt. På den lavteknologiske side, vi har selektivt opdrættet afgrøder i lang tid. Når landmænd faldt over en saftig appelsin eller en farvestrålende tomat, de bevarede de ønskelige gener ved at plante frø fra den plante.
Men i de senere år har vi har sparket bioteknologien et stykke op. I begyndelsen af 2000'erne, forskere fandt ud af, hvordan man bruger enzymer, kaldet zinkfingernukleaser, at slette og erstatte specifikke uønskede gener i en række forskellige organismer. Zinkfingerenzymer, imidlertid, var dyre (op til $ 5, 000 en pop), svært at lave, og succesraten var ikke optimal [kilde:Ledford].
Så mens teknologien til at redigere gener var der, det var ikke før CRISPR kom, at tanken om bevidst at ændre en organismes DNA føltes inden for rækkevidde. Den første reference til CRISPR var i en tidsskriftartikel fra 1987, hvor forskere rapporterede at finde de korte gentagelser af DNA, der er grundlaget for teknologien i E coli bakterie. Men det var først i 2012, at CRISPR blev relevant. Siden da, brugen af CRISPR er skudt i vejret i det videnskabelige samfund. Mere end en milliard dollars er blevet indsamlet som startkapital for bioteknologiske virksomheder, der bruger teknikken [kilde:Ledford]. Statens finansiering til CRISPR -forskning er også gennem taget.
Alene i 2014, tæt på $ 90 millioner blev forpligtet af National Institutes of Health til CRISPR -forskning [kilde:Ledford]. Og siden 2010 har over 200 patenter relateret til CRISPR er blevet indgivet [kilde:Ledford]. Det hurtige forskningstempo ser ikke ud til at aftage. Efterhånden som forskere lærer mere om CRISPR, det ser ud til, at de lærer mindre om, hvordan teknikken er begrænset, og i stedet om, hvor kraftfuld den er. T
Så hvad er det ved denne teknik, der gør den så kraftfuld?
Designer babyer, Invasive mutanter og DIY -biologi
I 1987, forskere studerer E coli opdagede gentagne segmenter i bakteriens DNA. Denne type mønster i bakterielt DNA er usædvanlig, så de pigede op, da de lagde mærke til det, og rapporterede fund. Over tid, forskere begyndte at se dette mønster i mange forskellige typer bakterier, men der var stadig ingen hypotese for, hvad det var, og hvorfor det var der. Men i 2005, en søgning i en DNA -database viste, at de "klyngede, regelmæssigt mellemliggende korte palindromiske gentagelser" (eller CRISPR) matchede virus -DNA.
Men hvorfor ville bakterier have gemt væk virus -DNA? Forskeren Eugene Koonin antog, at når bakterier overlever et virusangreb, de skærer virussen op i små stykker og gemmer noget af virus -DNA'et i deres eget genom, så de senere kan genkende og angribe virussen, hvis de tilfældigvis møder den igen. De gemmer dybest set et billede af virussen i baglommen, så de kunne genkende den dårlige fyr, hvis han nogensinde skulle dukke op igen - en bemærkelsesværdig forsvarsmekanisme for det bakterielle immunsystem.
Koonins hypotese var rigtig. Hvis den virus rammer igen, bakterierne fremstiller særlige "snigmordere". Disse snigmordere kan læse RNA -sekvensen for ethvert virus -DNA, de løber ind i, genkende, om det matcher de oplysninger, de har gemt i deres DNA, fange det og hugge det op. Det er som om bakterierne har skabt meget specifikke, smart saks.
Denne opdagelse var temmelig sej, men ikke så cool som University of California, Berkeley -forskeren Jennifer Doudna (som siden har vundet Nobelprisen i kemi i 2020 med Emmanuelle Charpentier for deres arbejde med CRISPR) tænkte at have at gøre med oplysningerne. Hun foreslog, at forskere kunne bruge CRISPR som et værktøj til at hjælpe dem med at redigere gener. Hvis de udstyrede bakterierne med et segment af DNA, der vides at være dårligt - sig et gen, der forårsager blindhed - kunne de sende bakterierne ind for at opsøge det dårlige gen, hvor bakterierne ville finde det og myrde det. Og så kunne vi drage fordel af den naturlige reparationsmekanisme i bakteriecellerne for at smide et mere ønskeligt gen i stedet [kilde:RadioLab].
Det virkede! Og det blev ved med at fungere! At vende blindhedsmutationer har bare været en af de måder, CRISPR har vist sig at fungere på. Det har stoppet kræftceller i at formere sig, gjort celler uigennemtrængelige for hiv, hjalp os med at skabe sygdomsresistent hvede og ris, og utallige andre fremskridt. I 2015, Kinesiske forskere forsøgte endda at bruge teknologien på ikke -levedygtige menneskelige embryoner, men i kun få tilfælde foretog CRISPR de rigtige nedskæringer af DNA [kilde:Maxmen].
Men dette rejser spørgsmålet:Vil vi overhovedet bruge det på embryoner? Skal vi have lov til det? Hvem vil regulere brugen af CRISPR?
Masser mere information
CRISPR -teknologien er så relativt ny, at det videnskabelige samfund endnu ikke fuldt ud har forstået al sin magt. Men en ting er sikkert - de ved, at dets evne til at påvirke den menneskelige race kan være uovertruffen af enhver anden bioteknologi. Med det store potentiale, behovet for at udvikle regler omkring dets anvendelse er bydende nødvendigt. Men det voldsomme tempo, hvormed der forskes i laboratoriet, har ikke givet meget tid til diskussion af, hvad reglerne omkring forskning og brug skal være. Det lyder fantastisk, at CRISPR kan skære dårligt væk, uønskede gener og erstatte dem med mere ønskelige. Men hvem skal sige, hvad der er dårligt, og hvad der er godt?
Uden nogen regler, CRISPR kunne udvikles til det punkt, hvor det sikkert kan bruges på et menneskeligt embryo til at ændre dets DNA. Ville nogen forælder sige nej til CRISPR, hvis de lærte, at deres barn havde genet for Huntingtons sygdom, og at CRISPR kunne fjerne det, før barnet blev født? Og hvis vi tillod forældre at træffe disse beslutninger om at rode med deres babys DNA, før han eller hun blev født, hvor ville det stoppe? Kunne de beslutte at gøre deres baby høj i stedet for kort? Blond i stedet for brunette? De ændringer, som forældrene kunne vælge at bibringe deres barn, ville være permanente ændringer, der ville gå videre i generationer. Hvis dette scenario udspiller sig, det er let at se, hvordan det kunne fremme skillet mellem have og have-ikke. Og vi ved ikke, hvad der kan ske på lang sigt med et barn, hvis gener erstattes.
I december 2015, en gruppe forskere, bioetikere og politikeksperter fra forskellige lande mødtes for at tale om regulering af menneskelig genredigering. En amerikansk ekspert nævnte, at Food and Drug Administration ikke bare skulle regulere teknologien, men specifikke anvendelser af den for at forhindre off-label brug. Hun nævnte også, at der kan være større risiko ved at redigere plantegener end at redigere menneskelige gener [kilde:Regulatory Affairs Professionals Society].
Med denne teknologis store kraft, spørgsmål om CRISPR skal behandles adskilt fra dem om genetisk modificerede organismer. At få alle på tværs af verden på samme side, imidlertid, vil fortsat være en udfordring.
Oprindeligt udgivet:3. maj, 2016
Masser mere information
Forfatterens note:Sådan fungerer CRISPR genredigering
At skrive artikler som denne skræmmer mig. Denne teknologi er sådan, så spændende. Implikationerne virker generelt så meget seje, men det føles også som om, at vi er begyndt at finde ud af så meget om, hvordan man manipulerer livet med teknologi, at vi er nødt til at ødelægge på et tidspunkt. CRISPR giver os så meget magt - og på måder, som vi ikke kan forudse. Verden fungerer godt, du ved? At rode med det er bare skræmmende. Så igen, hvordan kunne vi ignorere en så stærk teknik, der kunne hjælpe os på så mange måder?
relaterede artikler
- 10 misforståelser om GMO'er
- Sådan fungerer evolution
- Sådan fungerer genbanker
- Er det etisk at bruge stamceller?
Flere store links
- Radiolab:Antistoffer Del 1:CRISPR
- Wired Magazine:Genesis Engine
Kilder
- Brennan, Zachary. "Human Gene Editing, CRISPR og FDA:Hvordan vil de blande sig? "Regulatory Affairs Professional Society. 2. december, 2015. (29. april kl. 2016) http://www.raps.org/Regulatory-Focus/News/2015/12/02/23708/Human-Gene-Editing-CRISPR-and-FDA-How-Will-They-Mix/
- Brun, Kristen V. "Inde i garagelaboratorierne for DIY -genhackere, hvis hobby kan skræmme dig. "Fusion. 29. marts, 2016. (13. april, 2016) http://fusion.net/story/285454/diy-crispr-biohackers-garage-labs/
- Ledford, Heidi. "CRISPR, forstyrrelsen. "Nature. bind 522. side 20-24. 2015.
- Ledford, Heidi. "CRISPR, forstyrrelsen. "Nature. bind 522. side 20-24. 2015. http://www.nature.com/news/crispr-the-disruptor-1.17673
- Maxmen, Amy. "Genesis Engine." Kablet. August 2015. (13. april, 2016) http://www.wired.com/2015/07/crispr-dna-editing-2/
- Radiolab. "Antistoffer del 1:CRISPR" 6. juni, 2015. (13. april, 2016) http://www.radiolab.org/story/antibodies-part-1-crispr/
- Regalado, Antonio. "Hvem ejer århundredets største bioteknologiske opdagelse?" MIT Technology Review. 4. dec. 2014. (19. april, 2016) https://www.technologyreview.com/s/532796/who-owns-the-biggest-biotech-discovery-of-the-century/
- Petree, Jessica. Kandidatstuderende i kemi, Emory University. Personlig korrespondance. 13. april kl. 2015.
- Stoye, Emma. "Crispr-redigeret svamp dodges regulering." Kemi Verden. 26. april kl. 2016. (29. april kl. 2016) http://www.rsc.org/chemistryworld/2016/04/crispr-gene-editing-mushroom-dodges-gmo-regulation
- Zimmer, Carl. "Gennembrud DNA -redaktør født af bakterier." Quanta Magazine. 6. februar kl. 2015. (13. april, 2016) https://www.quantamagazine.org/20150206-crispr-dna-editor-bacteria/
 Varme artikler
Varme artikler
-
 Hvorfor gør det for svært at vælge for mange valgmuligheder?Nogle gange har vi flere valgmuligheder, når vi handler, jo mere overvældede vi kan blive. iStockphoto/Thinkstock Hvis du nogensinde har kørt ind i købmanden for at hente et glas tandpasta, du er san
Hvorfor gør det for svært at vælge for mange valgmuligheder?Nogle gange har vi flere valgmuligheder, når vi handler, jo mere overvældede vi kan blive. iStockphoto/Thinkstock Hvis du nogensinde har kørt ind i købmanden for at hente et glas tandpasta, du er san -
 Har planteceller Flagella?Planteceller og dyreceller ligner på mange måder, men også forskellige i andre. Plante celler kan fotosynteses, for eksempel mens dyreceller ikke kan. En af de vigtige forskelle mellem plante- og dyre
Har planteceller Flagella?Planteceller og dyreceller ligner på mange måder, men også forskellige i andre. Plante celler kan fotosynteses, for eksempel mens dyreceller ikke kan. En af de vigtige forskelle mellem plante- og dyre -
 Ligning for glukosemetabolisme6 CO2 + 6 H2O, hvor 2870 kilojoule energi frigives for hver mol glukose, der metaboliseres. Selvom denne ligning beskriver den overordnede proces, er dens enkelhed vildledende, fordi den skjuler al
Ligning for glukosemetabolisme6 CO2 + 6 H2O, hvor 2870 kilojoule energi frigives for hver mol glukose, der metaboliseres. Selvom denne ligning beskriver den overordnede proces, er dens enkelhed vildledende, fordi den skjuler al -
 Top 5 uløste hjernemysterierHans Neleman/Stone/Getty Images Når du sammenligner hjernens detektiver, neurovidenskabsfolk, til andre detektiver, neurovidenskabsmændene synes at komme til kort med at løse mysterier. Trods alt, Ag
Top 5 uløste hjernemysterierHans Neleman/Stone/Getty Images Når du sammenligner hjernens detektiver, neurovidenskabsfolk, til andre detektiver, neurovidenskabsmændene synes at komme til kort med at løse mysterier. Trods alt, Ag


