Hvad er grundlaget for undtagelser fra Aufbau-princippet?
Aufbau betyder "opbygning" på tysk, og Aufbau-princippet siger, at elektroner fylder elektronskaller omkring atomer i henhold til energiniveauet. Dette betyder, at elektronskaller og underskaller omkring atomer er fyldt indefra og ud, undtagen i nogle tilfælde, hvor en ydre skal har et lavt energiniveau og delvis fyldes op, før en indre skal er fuld.
TL; DR ( For lang; læste ikke)
Undtagelser fra Aufbau-princippet er baseret på det faktum, at nogle få atomer er mere stabile, når deres elektroner fylder eller halvfylder en elektronskal eller underskal. I henhold til Aufbau-princippet skal disse elektroner altid fylde skaller og underskaller i henhold til stigende energiniveau. Elementer som kobber og krom er undtagelser, fordi deres elektroner fylder og halvfylder to underskaller, med nogle elektroner i skaller med højere energiniveau. diskrete energiniveau kaldet skaller. Det laveste energiniveau er tættest på kernen, og det har kun plads til to elektroner i et skal kaldet s-skallen. Den næste skal har plads til otte elektroner i to underskaller, s og p-underskaller. Den tredje skal har plads til 18 elektroner i tre underskaller, s, p og d underskaller. Den fjerde skal har fire underskaller, der tilføjer f-underskallen. De bogstaverede underskaller har altid plads til det samme antal elektroner: to til s-underskallen, seks for p, 10 for d og 14 for f.
For at identificere en underskal gives det nummeret på hoved "shell and the letter of the subshell.", 3, [[F.eks. Har brint sin eneste elektron i 1-skalet, mens ilt med otte elektroner har to i 1-skalet, to i 2-underskallet og fire i 2p-undersiden. Underskalene udfyldes i rækkefølge af deres tal og bogstaver op til den tredje skal.
Underskalene 3s og 3p udfyldes med to og seks elektroner, men de næste elektroner går ind i 4s underskal, ikke 3d subshell som forventet. 4s subshell har et lavere energiniveau end 3d subshell og udfyldes derfor først. Selvom tallene er ude af rækkefølge, respekterer de Aufbau-princippet, fordi elektronunderskallene udfyldes i henhold til deres energiniveau.
Sådan fungerer undtagelserne
Aufbau-princippet gælder for næsten alle elementer, især inden for lavere atomnummer. Undtagelser er baseret på det faktum, at halvfyldte eller fulde skaller eller underskaller er mere stabile end delvist fyldte. Når forskellen i energiniveauer mellem to underskaller er lille, kan en elektron overføre til det højere niveau skal for at udfylde eller halvfylde det. Elektronen optager skallen på det højere energiniveau i strid med Aufbau-princippet, fordi atomet er mere stabilt på den måde.
Fuldt eller halvfulde underskaller er meget stabilt og har et lavere energiniveau end ellers ville have. For nogle få elementer ændres den normale sekvens af energiniveauer på grund af fulde eller halvfulde underskaller. For elementer med højere atomnummer bliver forskellene i energiniveauet meget små, og ændringen på grund af udfyldning af et underskal er mere almindeligt end ved lavere atomantal. F.eks. Er ruthenium, rhodium, sølv og platin alle undtagelser fra Aufbau-princippet på grund af fyldte eller halvfyldte underskaller.
I det lavere atomnummer er forskellen i energiniveauer for den normale sekvens af elektronskaller er større, og undtagelser er ikke så almindelige. I de første 30 elementer er kun kobber, atomnummer 24 og krom, atomnummer 29 undtagelser fra Aufbau-princippet.
Af kobberens samlede 24 elektroner fylder de energiniveauet ud med to i 1s , to i 2'ere, seks i 2p, to i 3'ere og seks i 3p for i alt 18 i de lavere niveauer. De resterende seks elektroner skal gå i 4s og 3d subshells, med to i 4s og fire i 3d. I stedet for, at d-delskaffen har plads til 10 elektroner, tager 3d-underskallen fem af de seks tilgængelige elektroder og efterlader en til 4s-undersiden. Nu er både 4'erne og 3d-underskalene halvfyldte, en stabil konfiguration, men en undtagelse fra Aufbau-princippet.
Tilsvarende har krom 29 elektroner med 18 i de nederste skaller og 11 tilbage. Efter Aufbau-princippet skal to gå til 4'er og ni til 3d. Men 3d kan indeholde 10 elektroner, så kun en går i 4'ere for at gøre den halvfuld og 10 gå ind i 5d for at udfylde den. Aufbau-princippet fungerer næsten hele tiden, men undtagelser forekommer, når underskaller er halvfulde eller fulde.
Sidste artikelHvordan bestemte Watson og Crick baseparring?
Næste artikelHvad er vigtigheden af virtuel virkelighed for læger og kirurger?
 Varme artikler
Varme artikler
-
 Har alle celler mitokondrier?Mitochondrion, en organel, der hjælper med at producere energi til cellen, findes kun i eukaryoter, organismer med relativt store, komplekse celler. Som sådan har mange celler og encellede organismer
Har alle celler mitokondrier?Mitochondrion, en organel, der hjælper med at producere energi til cellen, findes kun i eukaryoter, organismer med relativt store, komplekse celler. Som sådan har mange celler og encellede organismer -
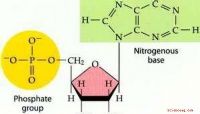 Hvad hedder DNA-underenheden?Deoxyribonukleinsyre, eller DNA, er molekylet, der indeholder den genetiske information i cellerne i en organisme. Underenhederne af en DNA-streng kaldes nukleotider. Egenskaber Består af en fem-c
Hvad hedder DNA-underenheden?Deoxyribonukleinsyre, eller DNA, er molekylet, der indeholder den genetiske information i cellerne i en organisme. Underenhederne af en DNA-streng kaldes nukleotider. Egenskaber Består af en fem-c -
 Hvad er nogle af de mest almindelige anvendelser af gær?gær er en encellede organismer, der formerer sig aseksuelt og er blevet brugt til bagning og brygning i tusinder af år. Der er mindst 1.500 gærarter, som alle er teknisk levende organismer. Gær foreko
Hvad er nogle af de mest almindelige anvendelser af gær?gær er en encellede organismer, der formerer sig aseksuelt og er blevet brugt til bagning og brygning i tusinder af år. Der er mindst 1.500 gærarter, som alle er teknisk levende organismer. Gær foreko -
 Forskningsemner inden for bioteknologiBiokemikere og andre forskningsfolk, der arbejder inden for bioteknologi, kan forvente bedre end gennemsnitlig jobvækst mellem 2008 og 2018, ifølge fremskrivninger fra U.S. Bureau of Labor Statisti
Forskningsemner inden for bioteknologiBiokemikere og andre forskningsfolk, der arbejder inden for bioteknologi, kan forvente bedre end gennemsnitlig jobvækst mellem 2008 og 2018, ifølge fremskrivninger fra U.S. Bureau of Labor Statisti


