Forskere leder bakterier med udvidet genetisk kode til at udvikle ekstrem varmetolerance
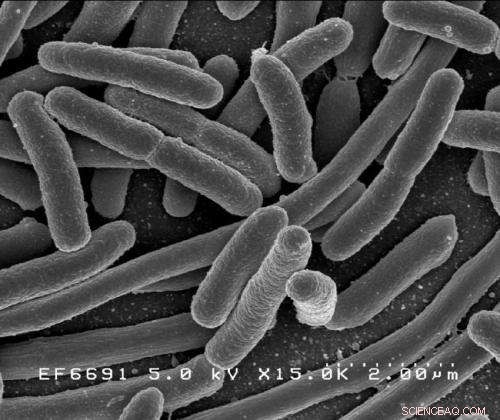
Escherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH
I de seneste år, forskere har konstrueret bakterier med udvidede genetiske koder, der producerer proteiner fremstillet af et bredere spektrum af molekylære byggesten, åbner en lovende front inden for proteinteknik.
Nu, Forskere fra Scripps Research har vist, at sådanne syntetiske bakterier kan udvikle proteiner i laboratoriet med forbedrede egenskaber ved hjælp af mekanismer, der muligvis ikke er mulige med naturens 20 aminosyre byggesten.
Udsættelse af bakterier med en kunstigt udvidet genetisk kode for temperaturer, hvor de normalt ikke kan vokse, forskerne fandt ud af, at nogle af bakterierne udviklede nye varmebestandige proteiner, der forbliver stabile ved temperaturer, hvor de typisk ville inaktiveres. Forskerne rapporterede deres fund i Journal of the American Chemical Society ( JACS ).
Næsten hver organisme på jorden bruger de samme 20 aminosyrer som byggestenene til at lave proteiner - de store molekyler, der udfører de fleste cellulære funktioner. Peter Schultz, Ph.d., seniorforfatteren af JACS papir og præsident og administrerende direktør for Scripps Research, banebrydende en metode til omprogrammering af cellens eget proteinbiosyntetiske maskineri til tilføjelse af nye aminosyrer til proteiner, betegnet ikke-kanoniske aminosyrer (ncAA'er), med kemiske strukturer og egenskaber, der ikke findes i de almindelige 20 aminosyrer.
Denne udvidede genetiske kode er tidligere blevet brugt til rationelt at designe proteiner med nye egenskaber til brug som værktøjer til at studere, hvordan proteiner fungerer i celler og som nye præcisionsfremstillede lægemidler til kræft. Forskerne spurgte nu, om syntetiske bakterier med udvidede genetiske koder har en evolutionær fordel i forhold til dem, der er begrænset til 20 byggesten - er en 21 aminosyre kode bedre end en 20 aminosyre kode fra et evolutionært fitnessperspektiv?
"Lige siden vi først udvidede rækken af aminosyrer, der kan inkorporeres i proteiner, der er gået meget arbejde med at bruge disse systemer til at konstruere molekyler med nye eller forbedrede egenskaber, "siger Schultz." Her, Vi har vist, at man ved at kombinere en udvidet genetisk kode med en laboratorieudvikling kan skabe proteiner med forbedrede egenskaber, som måske ikke let kan opnås med naturens mere begrænsede sæt. "
Forskerne startede med at tilpasse genomet til E coli så bakterierne kunne producere proteinet homoserin o-succinyltransferase (metA) ved hjælp af en 21 aminosyrekode i stedet for den almindelige 20 aminosyrekode. Et vigtigt metabolisk enzym, metA dikterer den maksimale temperatur, hvormed E coli kan trives. Over den temperatur, metA begynder at inaktivere og bakterierne dør. Forskerne lavede derefter mutanter af metA, hvor næsten enhver aminosyre i det naturlige protein kunne erstattes med en 21. ikke -kanoniske aminosyre.
På dette tidspunkt, de lod den naturlige selektion - den centrale udviklingsmekanisme - virke sin magi. Ved at opvarme bakterierne til 44 grader Celsius - en temperatur, hvor normalt metA -protein ikke kan fungere, og som følge heraf, bakterier kan ikke vokse - forskerne lægger selektivt pres på bakteriepopulationen. Som forventet, nogle af de mutante bakterier var i stand til at overleve ud over deres typiske temperaturloft, takket være besiddelsen af en mutant metA, der var mere varmestabil - alle andre bakterier døde.
På denne måde, forskerne var i stand til at drive bakterierne til at udvikle et mutant metA -enzym, der kunne modstå temperaturer 21 grader højere end normalt, næsten dobbelt så høj termisk stabilitet, som folk typisk opnår, når de er begrænset til mutationer begrænset til de almindelige 20 aminosyre byggesten.
Forskerne identificerede derefter den specifikke genetiske sekvensændring, der resulterede i mutant metA og fandt, at det skyldtes de unikke kemiske egenskaber ved en af deres ikke -kanoniske aminosyrer, som laboratorieudviklingen udnyttede på en smart måde til at stabilisere proteinet.
"Det er slående, hvordan en sådan lille mutation med en ny aminosyre, der ikke er til stede i naturen, fører til en så markant forbedring af proteinets fysiske egenskaber, «siger Schultz.
"Dette eksperiment rejser spørgsmålet om, hvorvidt en 20 aminosyrekode er den optimale genetiske kode - hvis vi opdager livsformer med udvidede koder, vil de have en evolutionær fordel, og hvordan ville vi se ud, hvis Gud havde arbejdet på den syvende dag og tilføjet nogle flere aminosyrer til koden? "
 Varme artikler
Varme artikler
-
 UCI-forskere er de første til at observere, billede altafgørende molekylære vibrationerVi har et mikroskop nu, der kan opløse atomer, og vi bruger det til at se ind i molekyler, hvilket var utænkeligt for kun få år siden, siger studiemedforfatter V. Ara Apkarian (til højre), direktør fo
UCI-forskere er de første til at observere, billede altafgørende molekylære vibrationerVi har et mikroskop nu, der kan opløse atomer, og vi bruger det til at se ind i molekyler, hvilket var utænkeligt for kun få år siden, siger studiemedforfatter V. Ara Apkarian (til højre), direktør fo -
 Foldende proteiner mærker varmen, og koldtEn illustration viser dynamikken i proteinfoldning i en opløsning som tidligere forstået og som afsløret af nye modeller udviklet på Rice University, Tulane University og Johns Hopkins University Scho
Foldende proteiner mærker varmen, og koldtEn illustration viser dynamikken i proteinfoldning i en opløsning som tidligere forstået og som afsløret af nye modeller udviklet på Rice University, Tulane University og Johns Hopkins University Scho -
 Gentagelsesnøgle til selvhelbredelse, fleksibelt medicinsk udstyrProtonledningsevnemålinger af proteinmembraner ved hjælp af impedansspektroskopi. Kredit:Abdon Pena-Franchesch Medicinsk udstyr drevet af syntetiske proteiner skabt af gentagne sekvenser af protei
Gentagelsesnøgle til selvhelbredelse, fleksibelt medicinsk udstyrProtonledningsevnemålinger af proteinmembraner ved hjælp af impedansspektroskopi. Kredit:Abdon Pena-Franchesch Medicinsk udstyr drevet af syntetiske proteiner skabt af gentagne sekvenser af protei -
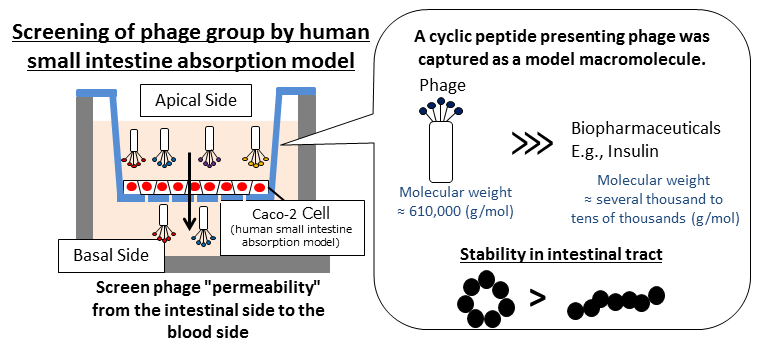 Tyndtarmspermeable peptider letter optagelsen af fordøjelseskanalenOralt administrerede biofarmaceutiske midler skal gennemtrænge humane tyndtarmsepitelceller. Dette kan gøres ved at identificere innovative cykliske peptider, der letter tyndtarmsabsorptionen af fag
Tyndtarmspermeable peptider letter optagelsen af fordøjelseskanalenOralt administrerede biofarmaceutiske midler skal gennemtrænge humane tyndtarmsepitelceller. Dette kan gøres ved at identificere innovative cykliske peptider, der letter tyndtarmsabsorptionen af fag
- Blanding af det gamle og det nye - bevaring af klippekunst med et tryk på en knap
- MaNGA-dataudgivelsen inkluderer detaljerede kort over tusindvis af nærliggende galakser
- Opskalering af turbulens for bedre laboratorieundersøgelser
- Unikke exoplanet fotobomber Cheops satellitundersøgelse af nærliggende stjernesystem
- Mennesker koloniserede forskellige miljøer i Sydøstasien og Oceanien under Pleistocæn
- 3,5 procent af de globale metanforekomster kan være smeltet i 2100 på grund af klimaændringer


