Vejning og billeddannelse af molekyler et ad gangen
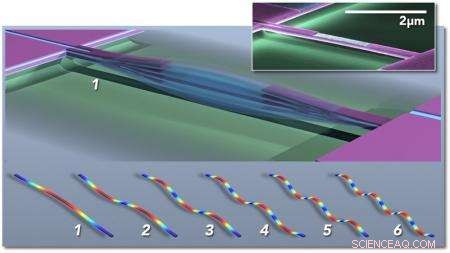
Multimode nanoelektromekaniske systemer (NEMS) baseret massesensor; hovedfiguren viser skematisk en dobbeltspændt stråle, der vibrerer i fundamental tilstand (1). Konceptuelle "snapshots" af de første seks vibrationstilstande er vist nedenfor (1-6), farver indikerer høj (rød) til lav (blå) belastning. Indsatsen viser et farvet elektronmikrografi af en piezoelektrisk NEMS-resonator fremstillet i Caltechs Kavli Nanoscience Institute. Kredit:M. Matheny, L.G. Villanueva, P. Hung, J. Li og M. Roukes/Caltech
Bygger på deres skabelse af den første mekaniske enhed nogensinde, der kan måle massen af individuelle molekyler, en ad gangen, et hold af Caltech-forskere og deres kolleger har skabt nanoenheder, der også kan afsløre deres form. Sådan information er afgørende, når man forsøger at identificere store proteinmolekyler eller komplekse samlinger af proteinmolekyler.
"Du kan forestille dig, at med store proteinkomplekser lavet af mange forskellige, mindre underenheder er der mange måder at samle dem på. Disse kan ende med at have ret ens masser, mens de faktisk er forskellige arter med forskellige biologiske funktioner. Dette gælder især med enzymer, proteiner, der medierer kemiske reaktioner i kroppen, og membranproteiner, der styrer en celles interaktioner med dens omgivelser, " forklarer Michael Roukes, Robert M. Abbey professor i fysik, Anvendt fysik, og Bioengineering hos Caltech og den tilsvarende forfatter til et papir, der beskriver teknologien, der udkom den 30. marts i onlineudgaven af tidsskriftet Natur nanoteknologi .
Et grundlag for genomikrevolutionen har været evnen til at replikere DNA- eller RNA-molekyler i massevis ved hjælp af polymerasekædereaktionen til at skabe de mange millioner kopier, der er nødvendige for typisk sekventering og analyse. Imidlertid, den samme masseproduktionsteknologi virker ikke til kopiering af proteiner. Lige nu, hvis du vil identificere et bestemt protein korrekt, du har brug for en masse af det - typisk millioner af kopier af netop det protein, du er interesseret i, med meget få andre fremmede proteiner som kontaminanter. Den gennemsnitlige masse af denne molekylære population evalueres derefter med en teknik kaldet massespektrometri, hvori molekylerne ioniseres - så de opnår en elektrisk ladning - og derefter får lov til at interagere med et elektromagnetisk felt. Ved at analysere denne interaktion, videnskabsmænd kan udlede forholdet mellem molekylvægt og ladning.
Men massespektrometri kan ofte ikke skelne subtile, men afgørende forskelle i molekyler med lignende masse-til-ladning-forhold. "Med massespektrometri i dag, " forklarer Roukes, "store molekyler og molekylære komplekser hugges først op i mange mindre stykker, det er, til mindre molekylefragmenter, som eksisterende instrumenter kan håndtere. Disse forskellige fragmenter analyseres separat, og så bruges bioinformatik – der involverer computersimuleringer – til at samle puslespillet igen. Men denne gensamlingsproces kan forpurres, hvis stykker af forskellige komplekser blandes sammen."
Med deres enheder, Roukes og hans kolleger kan måle massen af et individuelt intakt molekyle. Hver enhed - som kun er et par milliontedele af en meter i størrelse eller mindre - består af en vibrerende struktur kaldet en nanoelektromekanisk system (NEMS) resonator. Når en partikel eller et molekyle lander på nanoenheden, den tilføjede masse ændrer frekvensen, hvormed strukturen vibrerer, meget ligesom at sætte dråber af lodde på en guitarstreng ville ændre frekvensen af dens vibration og resulterende tone. De inducerede skift i frekvens giver information om partiklens masse. Men de også, som beskrevet i det nye blad, kan bruges til at bestemme den tredimensionelle rumlige fordeling af massen:dvs. partiklens form.
"En guitarstreng vibrerer ikke bare ved én frekvens, " siger Roukes. "Der er harmoniske i dens grundtone, eller såkaldte vibrationstilstande. Det, der adskiller en violinstreng fra en guitarstreng, er i virkeligheden de forskellige blandinger af disse forskellige harmoniske af grundtonen. Det samme gælder her. Vi har en hel masse forskellige toner, der kan ophidses samtidigt på hver af vores nanoenheder, og vi sporer mange forskellige toner i realtid. Det viser sig, at når molekylet lander i forskellige orienteringer, disse harmoniske forskydes anderledes. Vi kan derefter bruge inertibilleddannelsesteorien, som vi har udviklet, til at rekonstruere et billede i rummet af formen af molekylet."
"Den nye teknik afslører en tidligere urealiseret kapacitet af mekaniske sensorer, " siger professor Mehmet Selim Hanay fra Bilkent University i Ankara, Kalkun, en tidligere postdoc-forsker i Roukes-laboratoriet og med-førsteforfatter af papiret. "Tidligere har vi identificeret molekyler, såsom antistoffet IgM, udelukkende baseret på deres molekylvægte. Nu, ved at gøre det muligt at udlede både information om molekylvægt og form for det samme molekyle samtidigt, den nye teknik kan i høj grad forbedre identifikationsprocessen, og det er af betydning både for grundforskningen og medicinalindustrien."
I øjeblikket, molekylære strukturer dechifreres ved hjælp af røntgenkrystallografi, en ofte besværlig teknik, der involverer isolering, rensende, og derefter krystalliserende molekyler, og derefter evaluere deres form baseret på de diffraktionsmønstre, der produceres, når røntgenstråler interagerer med de atomer, der sammen danner krystallerne. Imidlertid, mange komplekse biologiske molekyler er svære, hvis ikke umulige, at krystallisere. Og, selv når de kan krystalliseres, den opnåede molekylære struktur repræsenterer molekylet i krystallinsk tilstand, som kan være meget forskellig fra strukturen af molekylet i dets biologisk aktive form.
"Du kan forestille dig situationer, hvor du ikke ved præcis, hvad du leder efter - hvor du er i opdagelsestilstand, og du forsøger at finde ud af kroppens immunrespons på et bestemt patogen, for eksempel, " siger Roukes. I disse tilfælde, evnen til at udføre enkelt-molekyle detektion og at få så mange separate bits information som muligt om det enkelte molekyle forbedrer i høj grad oddsene for at foretage en unik identifikation.
"Vi siger, at kræft ofte begynder med en enkelt afvigende celle, og hvad det betyder er, at selvom det kan være en af en mangfoldighed af lignende celler, der er noget unikt ved den molekylære sammensætning af den ene celle. Med denne teknik, vi har potentielt et nyt værktøj til at finde ud af, hvad der er unikt ved det, " tilføjer han.
Indtil nu, den nye teknik er blevet valideret ved hjælp af partikler af kendte størrelser og former, såsom polymer nanodråber. Roukes og kolleger viser, at med nutidens state-of-the-art nanoenheder, tilgangen kan give opløsning i molekylær skala - dvs. give evnen til at se de molekylære delkomponenter af individuelle, intakte proteinsamlinger. Gruppens nuværende indsats er nu fokuseret på sådanne udforskninger.
Scott Kelber, en tidligere kandidatstuderende i Roukes lab, er den anden medførsteforfatter af papiret, med titlen "Inertial billeddannelse med nanoelektromekaniske systemer." Professor John Sader fra University of Melbourne, Australien, og en gæstemedarbejder i fysik hos Caltech, er medkorresponderende forfatter. Yderligere medforfattere er Cathal D. O'Connell og Paul Mulvaney fra University of Melbourne. Arbejdet blev finansieret af en National Institutes of Health Director's Pioneer-pris, et Caltech Kavli Nanoscience Institute Distinguished Visiting Professorship, Fondation pour la Recherche et l'Enseignement Superieur i Paris, og det australske forskningsråds bevillingsordning.
 Varme artikler
Varme artikler
-
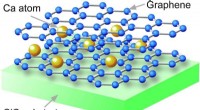 Grafen bliver superledende - Elektroner uden massestrøm uden modstandFig1. Krystalstruktur af Ca-interkaleret dobbeltlagsgrafen fremstillet på SiC-substrat. Indsættelse af Ca-atomer mellem to grafenlag forårsager superledningsevnen. Grafen er en enkeltatomisk kulst
Grafen bliver superledende - Elektroner uden massestrøm uden modstandFig1. Krystalstruktur af Ca-interkaleret dobbeltlagsgrafen fremstillet på SiC-substrat. Indsættelse af Ca-atomer mellem to grafenlag forårsager superledningsevnen. Grafen er en enkeltatomisk kulst -
 Siliciumchip med integreret laser:Lys fra en nanotrådBenedikt Mayer og Lisa Janker er på den molekylære stråleepitaxi-facilitet på Walter Schottky Institute, Münchens tekniske universitet. Kredit:Uli Benz / TUM Fysikere ved det tekniske universitet
Siliciumchip med integreret laser:Lys fra en nanotrådBenedikt Mayer og Lisa Janker er på den molekylære stråleepitaxi-facilitet på Walter Schottky Institute, Münchens tekniske universitet. Kredit:Uli Benz / TUM Fysikere ved det tekniske universitet -
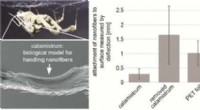 Edderkoppekamme tæmmer uregerlige nanofibreKredit:American Chemical Society Cribellate edderkopper spinder tusindvis af bittesmå nanofibre til klæbrige tråde. For at undgå at blive fanget i deres egne spind, disse edderkopper bruger en non
Edderkoppekamme tæmmer uregerlige nanofibreKredit:American Chemical Society Cribellate edderkopper spinder tusindvis af bittesmå nanofibre til klæbrige tråde. For at undgå at blive fanget i deres egne spind, disse edderkopper bruger en non -
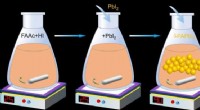 Højeffektive formamidinium-baserede perovskit-solceller med driftslevetid over 2000 timerForskerne brugte en pulverteknologisk metode til at skabe en højkvalitetsversion af FAPbI3. Først, de blandede formamidiniumacetat (FAAc) med hydroiodsyre (HI). PbI2 blev derefter tilsat. Blandingen b
Højeffektive formamidinium-baserede perovskit-solceller med driftslevetid over 2000 timerForskerne brugte en pulverteknologisk metode til at skabe en højkvalitetsversion af FAPbI3. Først, de blandede formamidiniumacetat (FAAc) med hydroiodsyre (HI). PbI2 blev derefter tilsat. Blandingen b
- Afskalningsbelægning holder afsaltningen renere og grønnere
- Om fødevarekæder i tundraøkosystemet
- Undersøgelse af mesosiderit zirkoner tyder på, at Vesta blev ramt af en meget stor sten
- Forskere udvikler et nanohybrid -køretøj til optimalt at levere medicin til menneskekroppen
- Kortere møder, men længere dage:Hvordan COVID-19 har ændret måden, vi arbejder på
- Reddit åbner Dublin -kontoret i år


