Moderne atomteori siger, at atomet er en diffus sky af omgivende lille tæt kerne.?
Her er hvorfor:
* Atomet er for det meste tomt rum: Dette er sandt. Kernen, der indeholder protoner og neutroner, er utroligt lille sammenlignet med atomets samlede størrelse. Elektronerne optager et meget større volumen og kredserer kernen.
* kernen er tæt: Ja, kernen er utrolig tæt, der indeholder næsten al masse af atomet i et lille rum.
* Elektronskyen: Elektroner kredser ikke kernen på en pæn, defineret sti som planeter omkring en sol. I stedet findes de i en skylignende region med sandsynlighed, hvor deres position og momentum er beskrevet af kvantemekanik.
Kortfattet: Moderne atomteori beskriver atomet som en lille, tæt kerne omgivet af en diffus sky af elektroner. Denne sky repræsenterer sandsynligheden for at finde elektroner i en bestemt region, ikke en bestemt bane.
Sidste artikelHvilke elementer efterlod Mendeleev plads til i sin første periodiske tabel?
Næste artikelHvad er atommassen af Krypton 92?
 Varme artikler
Varme artikler
-
 Fjerne gigantiske planeter dannes anderledes end fejlslagne stjernerDette billede af den brune dværg med lav masse GJ 504 B blev taget af Bowler og hans team ved hjælp af adaptiv optik med NIRC2-kameraet ved Keck Observatory på Hawaii. Billedet er blevet behandlet for
Fjerne gigantiske planeter dannes anderledes end fejlslagne stjernerDette billede af den brune dværg med lav masse GJ 504 B blev taget af Bowler og hans team ved hjælp af adaptiv optik med NIRC2-kameraet ved Keck Observatory på Hawaii. Billedet er blevet behandlet for -
 Opportunity afskedsbilledet var et smukt panoramaDette kommenterede billede er en beskåret version af det sidste 360-graders panorama taget af Opportunity-roverens Pancam fra 13. maj til 10. juni, 2018. Denne kommenterede visning er præsenteret i fa
Opportunity afskedsbilledet var et smukt panoramaDette kommenterede billede er en beskåret version af det sidste 360-graders panorama taget af Opportunity-roverens Pancam fra 13. maj til 10. juni, 2018. Denne kommenterede visning er præsenteret i fa -
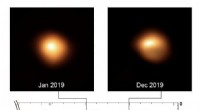 Undersøgelse af den supergigantiske stjerne Betelgeuse afslører årsagen til dens pulseringerNylige lysstyrkevariationer af Betelgeuse. Stjernepulsering får stjernens lysstyrke til at variere, men det store fald i lysstyrken i begyndelsen af 2020 er uden fortilfælde. En sammenligning af dir
Undersøgelse af den supergigantiske stjerne Betelgeuse afslører årsagen til dens pulseringerNylige lysstyrkevariationer af Betelgeuse. Stjernepulsering får stjernens lysstyrke til at variere, men det store fald i lysstyrken i begyndelsen af 2020 er uden fortilfælde. En sammenligning af dir -
 NASAs on-orbit service, Montage, og Manufacturing 1 (OSAM-1) mission klar til rumfartøjsbygningKredit:Maxar Technologies NASA er et skridt tættere på at optanke en satellit med robotter og demonstrere samling og fremstilling i rummet takket være fuldførelsen af en vigtig milepæl. I april
NASAs on-orbit service, Montage, og Manufacturing 1 (OSAM-1) mission klar til rumfartøjsbygningKredit:Maxar Technologies NASA er et skridt tættere på at optanke en satellit med robotter og demonstrere samling og fremstilling i rummet takket være fuldførelsen af en vigtig milepæl. I april
- I døde organismer Hvilken ændring ville du forvente over tid?
- Hvorfor identificerer så mange Gen Z'ere sig som LGBTQ? På grund af tidligere generationers ofre, …
- SLAP:Samtidig lokalisering og planlægning af autonome robotter
- Kommer Donald Trump tilbage til Facebook? Facebook kan ophæve forbuddet i januar, siger exec
- Gaming -elskere tager plads i Riyadh eSports -turnering
- Carbon nanorør-enheder kan have en grænse for, hvor nano de kan være


