Hvad er der nødvendigt for at bestemme orienteringen af en orbital?
1. Orbital vinkelmomentumnummer (L):
* Dette nummer beskriver formen på orbitalen og bestemmer antallet af orbitaler i et underskal.
* For eksempel svarer L =0 til en S-orbital (sfærisk), L =1 svarer til tre P-orbitaler (håndvægtformet), L =2 svarer til fem D-orbitaler (mere komplekse former) og så videre.
2. Det magnetiske kvantenummer (ML):
* Dette antal specificerer orienteringen af orbitalen i rummet i forhold til en valgt akse (normalt z-aksen).
* Det tager heltalværdier fra -l til +l, inklusive 0.
* For eksempel kan ML for L =1 (P orbitaler) være -1, 0 eller +1, svarende til tre forskellige orienteringer af det håndvægtformede orbital.
3. Det vigtigste kvantetal (n):
* Selvom det ikke er strengt krævet til orientering, er det nødvendigt at bestemme energiniveauet for orbitalen.
* Højere N -værdier indikerer højere energiniveau og større orbitaler.
Visualisering af orienteringen
For at visualisere orienteringen af en orbital kan du bruge:
* orbitaldiagrammer: Dette er grafiske repræsentationer af orbitaler, der viser deres former og rumlige orienteringer.
* Konturdiagrammer: Disse bruger linjer med konstant elektrondensitet for at illustrere fordelingen af elektronsandsynlighed inden for en orbital.
Eksempler
* En 2p orbital med ML =0 er orienteret langs z-aksen.
* En 3D -orbital med ML =-2 har en mere kompleks form og er orienteret på en bestemt måde inden for det tredimensionelle rum.
Vigtig note: Orienteringen af en orbital er i forhold til et valgt aksesystem. Du kan rotere aksesystemet, og orbitalernes orientering ændres i overensstemmelse hermed. Imidlertid vil orbitalens overordnede form og energi forblive den samme.
 Varme artikler
Varme artikler
-
 Historien om Roswell UFO -hændelsenImponerende mennesker mener, at dette vidt publicerede fotografi viser kroppen af en udenjordisk humanoid genoprettet fra nedbrudsstedet på en flyvende tallerken . Faktisk, figuren på billed
Historien om Roswell UFO -hændelsenImponerende mennesker mener, at dette vidt publicerede fotografi viser kroppen af en udenjordisk humanoid genoprettet fra nedbrudsstedet på en flyvende tallerken . Faktisk, figuren på billed -
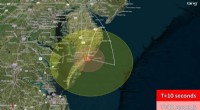 Eleveksperimenter at sprænge af fra NASA WallopsSynlighedskort. RockOn-lanceringen kan ses fra det sydlige Delaware til Chesapeake Bay-Bridge-tunnelen. Kredit:NASA Efter at være blevet udviklet via en virtuel læringsoplevelse, mere end 70 ekspe
Eleveksperimenter at sprænge af fra NASA WallopsSynlighedskort. RockOn-lanceringen kan ses fra det sydlige Delaware til Chesapeake Bay-Bridge-tunnelen. Kredit:NASA Efter at være blevet udviklet via en virtuel læringsoplevelse, mere end 70 ekspe -
 Lancering af NASA Mars rover forsinket igen, 2 uger tilbage til at flyveI denne 17. dec. 2019, filbillede stillet til rådighed af NASA, ingeniører ser den første køreprøve for Mars 2020-roveren Perseverance. i et rent rum på Jet Propulsion Laboratory i Pasadena, Californi
Lancering af NASA Mars rover forsinket igen, 2 uger tilbage til at flyveI denne 17. dec. 2019, filbillede stillet til rådighed af NASA, ingeniører ser den første køreprøve for Mars 2020-roveren Perseverance. i et rent rum på Jet Propulsion Laboratory i Pasadena, Californi -
 Ariane 5s sjette lancering i årDen 4. december 2018, Ariane 5 flight VA246 lettede fra Europas rumhavn i Fransk Guyana og leverede to satellitter, GSAT-11 og Geo-Kompsat-2A, ind i deres planlagte baner. Kredit:European Space Agency
Ariane 5s sjette lancering i årDen 4. december 2018, Ariane 5 flight VA246 lettede fra Europas rumhavn i Fransk Guyana og leverede to satellitter, GSAT-11 og Geo-Kompsat-2A, ind i deres planlagte baner. Kredit:European Space Agency
- Video:Kogende. Vi researcher. Du gavner.
- Hvordan er organiske makromolekyler og en afbalanceret diæt forbundet?
- Opladningsændring:Hvordan elektriske kræfter varierer i kolloider
- Hvorfor mikroplastikaffald kan være den næste store trussel mod vores have
- Forskere udvikler ny jordoverflademodel, herunder flere processer og menneskelige aktiviteter
- Hvad er ulemperne ved klassisk magnetisk teori?


