Hvor mange d orbital kan der være i et energiniveau?
Her er hvorfor:
* kvantetal: D orbitaler er kendetegnet ved vinkelmomentumnummeret (L) =2.
* Magnetisk kvantenummer: Det magnetiske kvantetal (ml) kan påtage sig værdier fra -l til +l, inklusive 0. For d orbitaler (l =2) kan ml være -2, -1, 0, +1, +2. Dette giver os fem mulige d orbitaler.
Vigtig note: D orbitaler vises først i det tredje energiniveau (n =3). De to første energiniveauer (n =1 og n =2) har kun S og P orbitaler.
 Varme artikler
Varme artikler
-
 Anæmisk galakse afslører mangler i teorien om ultra-diffus galaksedannelseDGSAT I, en ultra-diffus galakse. Kredit:uco/subaru Et hold af astronomer ledet af University of California Observatories (UCO) har studeret i detaljer en galakse, der er så svag og i så uberørt t
Anæmisk galakse afslører mangler i teorien om ultra-diffus galaksedannelseDGSAT I, en ultra-diffus galakse. Kredit:uco/subaru Et hold af astronomer ledet af University of California Observatories (UCO) har studeret i detaljer en galakse, der er så svag og i så uberørt t -
 Ny forskning viser, at Ceres muligvis har forsvindende isvulkanerAhuna Mons set i et simuleret perspektivbillede. Højden er blevet overdrevet med en faktor to. Udsigten blev lavet ved hjælp af forbedrede farvebilleder fra NASAs Dawn-mission. Kredit:NASA En nyli
Ny forskning viser, at Ceres muligvis har forsvindende isvulkanerAhuna Mons set i et simuleret perspektivbillede. Højden er blevet overdrevet med en faktor to. Udsigten blev lavet ved hjælp af forbedrede farvebilleder fra NASAs Dawn-mission. Kredit:NASA En nyli -
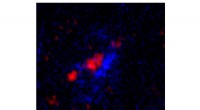 Astronomer finder ud af, at mørkt stof dominerer over kosmisk tidDette sammensatte billede af den støvede stjernedannende galakse DSFG850.95 viser unge stjerner, set i blåt fra Hubble Space Telescope, og støv, set i rødt af Atacama Large Millimeter/submillimeter Ar
Astronomer finder ud af, at mørkt stof dominerer over kosmisk tidDette sammensatte billede af den støvede stjernedannende galakse DSFG850.95 viser unge stjerner, set i blåt fra Hubble Space Telescope, og støv, set i rødt af Atacama Large Millimeter/submillimeter Ar -
 Ikke kun for at finde planeter:Exoplanet-jægeren TESS-teleskop opdager lyse gammastrålerTESS fuldformatbillede i kadencen lige før BAT-udløseren (venstre) og ved spidsfluxen af burst (midten). Fremkomsten af eftergløden er tydelig i midten af billedet, angivet med den hvide pil. De
Ikke kun for at finde planeter:Exoplanet-jægeren TESS-teleskop opdager lyse gammastrålerTESS fuldformatbillede i kadencen lige før BAT-udløseren (venstre) og ved spidsfluxen af burst (midten). Fremkomsten af eftergløden er tydelig i midten af billedet, angivet med den hvide pil. De
- Hvilken sætning beskriver bedst elektrontransportkæden i fotosyntesen?
- Amazon har til formål at gøre Alexa-assistenten til en større del af brugernes liv
- Hvad er uddannelseskravet for en kosmologi?
- Det faktum, at hver planeter kredse er en ellipse, blev opdaget af?
- Hvad skal man have større landformer afgrænset Kush øst og vest?
- Forskere søger forbi efter fremtidige klima -spor


