Komplet struktur af mitokondrielt respiratorisk superkompleks afkodet
Respiratorisk megakompleks struktur. Kredit: Celle (2017). DOI:10.1016/j.cell.2017.07.050
(Phys.org) – Stykke for stykke, kredsløbsdiagrammet for elektrontransport i mitokondrierne er kommet tættere på færdiggørelsen. Hver ny struktur opnået for et af de fem respiratoriske komplekser begrænser yderligere det samlede puslespil. Til sidst, store blokke er arrangeret i deres endelige placeringer. Den nøjagtige sammensætning af den største blok, den såkaldte megakompleks, har længe unddraget sig forskere. Nu, efter billeddannelse af 140 individuelle underenheder ned til 3,9 anstrom opløsning, den fulde Monty er blevet blotlagt. Forskere beskriver i Celle præcis hvordan det menneskelige respiratoriske megakompleks er sat sammen og ser ud til at fungere.
De enkle dage er væk. Ikke flere grove diagrammer med komplekser opstillet i membranen i en række fra et til fem med elektroner og deres mobile bærere, der sekventielt rejser gennem fra venstre mod højre. Kom med støkiometrien, og bringe på 2-D. Støkiometri betyder, at i virkeligheden hvert kompleks er faktisk repræsenteret i megakomplekset ved et bestemt kopinummer. Disse ekstra kopier skal gå et sted hen i enhver nøjagtig gengivelse. Ikke kun det, men de mindre elektronbærere har brug for en plads at hænge ud. De skal også være til stede i kanaler, der enten forbliver lokale for megakomplekset eller muligvis diffunderer væk til andre. Den endelige geometri vil diktere, hvor separate elektronbaner smelter sammen eller deler sig, og hvor de mest sandsynligt kører omvendt.
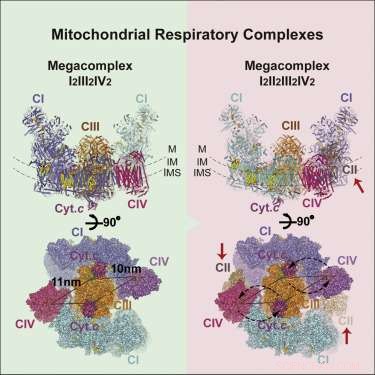
Billedet af megakomplekset (MC), der er fremkommet, har følgende støkiometri:MCI2II2III2IV2. Det betyder, at komplekser I, II, III, &IV er hver til stede i duplikat, mens kompleks V er fraværende. Den er konfigureret inden i membranen til en cirkulær struktur med den dimere CIII placeret i midten og tilført af perifere CI- og CIV-komplekser. CII-komplekserne er tilsyneladende ikke væsentlige krav til kernestrukturen, men er snarere teoretiseret til at blive kilet ind i huller efter behov. Forfatterne fandt også beviser for en let gengivelse af megakomplekset, der nogle gange kan samles med kun et enkelt CI-kompleks.
Den centrale placering af CIV-dimeren antyder en vis logik. CIV, eller cytochromoxidase, er den terminale hvilegrund for elektroner, der kommer ind i kæden. Dem, der når så langt, er blevet sænket ned i reduktionspotentialehierarkiet, så langt de kan nå. Her, de er sænket ned i ventende iltmolekyler, som derefter udtømmes som vandmolekyler. Højpotentiale elektroner pakket som NADH kommer ind i komplekset ved dets omkreds og ledes ind i midten. Fraværet af C5-komplekser er måske ikke så usædvanligt, i betragtning af, at de typisk findes som rækker af "V'-formede dimerer, der forvrider membranen til områder med høj krumning ved bøjninger i cristeaen.
Med den grundlæggende struktur i hånden, forskerne var i stand til at foreslå et par grundlæggende principper for drift. Deres inklusion og placering af CII forklarer effektivt omvendt elektrontransport fra succinat til NADH. Den foreslåede geometri skaber også en forseglet Q-pool (en lipidopløselig elektronbærer), som er tilgængelig for både CI og CII. Forfatterne var også i stand til at udpege identiteten og placeringen af flere lipidmolekyler, der sikrer komplekset inde i membranen, specifikt, flere pivotale molekyler af phosphatidylethanolamin, phosphatidylcholin, og cardiolipin. De var også i stand til at identificere foretrukne eller mest effektive elektronoverførselsveje, som igen begrænser, hvor mange elektroner der samtidigt kan overføres mellem aktive bærere.
Blandt de umiddelbare fordele ved dette nye arbejde er, at mange af de tidligere ufuldstændigt forståede patogene mutationer i respiratoriske proteiner nu giver mening. Før du har en megakompleks struktur, forskere havde intet andet valg end at fokusere på, hvordan mutationer påvirker strukturen eller funktionen af individuelle komplekser. Det viser sig, de fleste af de registrerede mutationer i kerneunderenheder Ci og CIII mål er i rester involveret i protein-protein-interaktionssteder mellem komplekser. (For eksempel, sygdomsassocierede mutationer i underenheder NDUFV1, NDUFS1, ND1, ND5, og ND6 i CI og underenhed MT-CYB i CIII). Dette viser nytteløsheden i at prøve kun at se på enkelte proteiner og underenheder i fravær af det større billede.
Det skal nævnes, at tidligere bestræbelser på at definere respiratorisk kompleks støkiometri har opnået lidt forskellige resultater afhængigt af hvilke organer og arter, der blev undersøgt. Kartoffel, ko, får, og gær, som ikke altid engang har et CI-kompleks at tale om, er alle blevet undersøgt. Det er ikke overraskende, at forskellige omstændigheder kan kræve forskellig støkiometri og form. Forskellige megakomplekse strukturer ville medføre forskellige fordele for substratkanalisering, katalytisk forbedring, sekvestrering af reaktive mellemprodukter, eller strukturel stabilisering. En undersøgelse, der specifikt så på mitokondrier i hjertet, satte forholdet for oxidative phosphoryleringskomplekser I:II:III:IV:V som 1:1,5:3:6:3. I dette tilfælde, forfatterne kaldte deres kompleks for "respirasomet".
Med respiratorisk megakompleks nu formentlig revnet, det næste store skridt fremad er at sætte nogle af de andre overbygninger af mitokondrielle dobbeltmembransystem ind i modeller for at forudsige, hvorfor cristea ser ud, som de gør. De massive TIM-TOM-importkomplekser spænder over begge membraner og er tæt forbundet med mitoribosomerne, der oversætter mitokondrielle proteiner. mitoribosomerne, på tur, er lokaliseret til underliggende membranassocierede nukleoider, der huser kopier af mtDNA. I analogi med kernens nucleolus, denne sammensatte nukleoid-ribosomstruktur er blevet betegnet 'mitokondriolen.' for eksempel, er den vigtigste shuttle i hjernen og ækvilibrerer de store metabolitter mellem mitokondrier og cytosol. Citrat-pyruvat-shuttlen til fedtsyresyntese og glycerolphosphat-shuttlen (i hvert fald til brunt fedt og insektflugtmuskler) skal også finde hjem, hvor de kan komme godt ud af det med de nærmeste naboer.
Den endemiske organisering af proteiner i disse megastrukturer tyder på, at mitokondrier kan ligne en hård krystal mere end en flydende protoplasma. Alligevel på en eller anden måde, de virker bemærkelsesværdigt smidige, når det kommer til fusion og fission. Hvad sker der med deres membranstruktur under denne slags ændringer? Er komplekserne midlertidigt adskilt og solubiliseret som det primære cilium og centriol i regulære celler under mitose? Et fascinerende nyt spor dukker op fra arbejde, der viser, at mitokondrier forbinder sig med hinanden gennem 'nanotunneler' af deres egen konstruktion. Disse nanotunneller er helt forskellige (så vidt vi ved) fra det cytoskelet-infunderede mærke af 'tunnelerende nanorør', som celler selv bruger til at overføre hele mitokondrier til hinanden.
En nylig anmeldelse fra Martin Picard og hans kolleger i Tendenser i cellebiologi foreslår en måde, hvorpå disse nanotunneller kan dannes, når mitokondrier fikseres til cytoskelettet. Hvis motorproteiner som kinesin får fat i et plaster af faste mitokondrier, det kunne trække en tynd nanotunnel ud, mens kinesinet kører mod en anden mikrotubuli. Mitokondriernes stive krop og dens membranstruktur ville formodentlig forblive intakt. Denne projektion kan så støde på en anden mitokondrier, som den bliver knyttet til.
Picard har tidligere vist, at omkring halvdelen af mitokondrierne i hjertemuskulaturen har intermitochondrial junctions (IMJ'er) og cristae, der er på linje i regelmæssige mønstre, der strækker sig på tværs af mitokondrielle netværk. Denne uhyggelige netværksjustering vil sandsynligvis ikke opstå fra nylige fissionshændelser, fordi hjertemitokondrier er fastgjort på plads og viser minimal fission/fusionsdynamik. IMJ'erne har for nylig vist sig at kontrollere kontraktilitet ved hurtigt afkoblede mitokondrier, når deres egne membraner depolariseres. En ting, der ville være af umiddelbar interesse, her, er at genundersøge respiratorisk underenhedsstøkiometri i humane hjertemitokondrier for at komplementere resultaterne rapporteret her for humane embryonale nyreceller.
© 2017 Phys.org
 Varme artikler
Varme artikler
-
 Kommercielle afstamningstest kan afsløre, hvor meget neandertaler -DNA du harMange mennesker har forfædres neandertaler -DNA i deres genom. Kan kommercielle DNA -tests fortælle dig, hvor meget neandertaler -DNA du har? Cristina Aries/Science Photo Library/Getty Images Hvis du
Kommercielle afstamningstest kan afsløre, hvor meget neandertaler -DNA du harMange mennesker har forfædres neandertaler -DNA i deres genom. Kan kommercielle DNA -tests fortælle dig, hvor meget neandertaler -DNA du har? Cristina Aries/Science Photo Library/Getty Images Hvis du -
 Protein begrænser saftoptagelse af bladlusBladlus. Kredit:Karen Kloth Forskere ved Umeå Universitet og Wageningen Universitet har opdaget, hvordan planter kan forsvare sig mod bladlus. De optog bladlusadfærd på video, og identificerede et
Protein begrænser saftoptagelse af bladlusBladlus. Kredit:Karen Kloth Forskere ved Umeå Universitet og Wageningen Universitet har opdaget, hvordan planter kan forsvare sig mod bladlus. De optog bladlusadfærd på video, og identificerede et -
 Forskere søger borgerforskere til at bidrage til verdensomspændende myggesporingEn forsker optager summende myg i et laboratorium. Kredit:Kurt Hickman/Stanford News Service Det er en lyd, der kan holde selv de trætteste blandt os fra at falde i søvn:den høje klynken fra en my
Forskere søger borgerforskere til at bidrage til verdensomspændende myggesporingEn forsker optager summende myg i et laboratorium. Kredit:Kurt Hickman/Stanford News Service Det er en lyd, der kan holde selv de trætteste blandt os fra at falde i søvn:den høje klynken fra en my -
 Sådan fungerer genterapiRent faktisk, du behøver ikke den kikkert for at se, at genterapiens fremtid nærmer sig. James Yang/© Images.com/Corbis Kan du huske Charlie Gordon? Han var stjernen i Flowers for Algernon, en anerke
Sådan fungerer genterapiRent faktisk, du behøver ikke den kikkert for at se, at genterapiens fremtid nærmer sig. James Yang/© Images.com/Corbis Kan du huske Charlie Gordon? Han var stjernen i Flowers for Algernon, en anerke
- Afslører hemmelighederne bag højenergiske kosmiske partikler
- Forskning løfter låget på pornografiens indflydelse
- Lungerne kan lide, når visse elementer bliver nano
- Forskere udvikler algoritme til at lokalisere falske brugere på mange sociale netværk
- Billede:Proba-V passerer faklen
- Hvad er fordelene ved uran minedrift?


