Ny intermolekylær overfladekraft afslører actomyosin -drivmekanisme
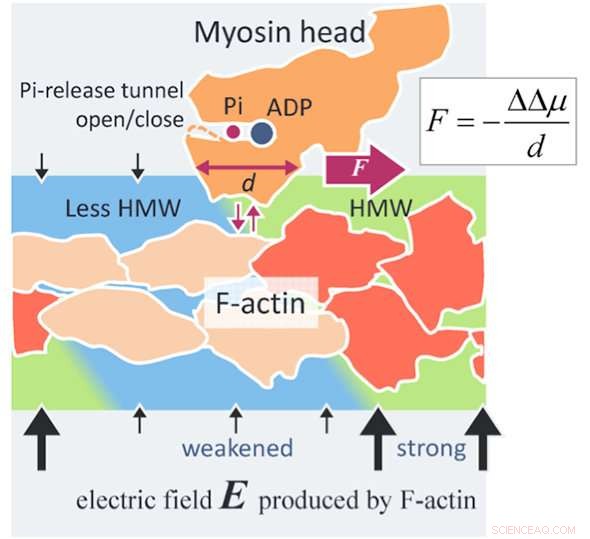
En ny kraftgenereringsmekanisme for actomyosin. Et aktinfilament (F-actin) producerer et elektrisk felt (sorte pile) så højt som 100 MV/m omkring F-actin på grund af dets negative overfladeladninger. Vandmolekylerne i et så højt elektrisk felt bliver til hyper-mobile vandmolekyler (HMW, lysegrøn) i nærheden af F-actin. På den anden side, ATP i opløsning binder med et myosinhoved (orange) og opdeles i adenosindiphosphat (ADP) og uorganisk phosphat (Pi) i hovedet. Når myosinhovedet med ADP og Pi binder med F-actin (orange rød), flere aktin -underenheder ændrer deres strukturer (beige). Derefter falder den elektriske feltstyrke omkring disse ændrede aktin -underenheder, og HMW -intensiteten falder også (lyseblå) for at blive tæt på frit vand. I denne undersøgelse, proteinhydreringstilstanden har vist sig at være mere stabil i den stærkere HMW -region. I figuren, myosinhovedet drives til højre, hvor HMW -intensiteten er stærkere (lysegrøn), med afmontering fra F-actin og fastgørelse igen med F-actin. Kraften vurderet ved den foreliggende metode er så høj som flere piconewtons, hvilket er på niveau med de eksperimentelle værdier. Dette kan være et princip om ny overfladekraft, der virker mellem et ladet makromolekyle, såsom protein og DNA, og et opløst protein bredt anvendeligt til videnskab og teknologi. Kredit:Makoto Suzuki
Aktin- og myosinkomplekset (actomyosin) genererer sammentrækningskraft af en muskel ved hjælp af adenosintrifosfat (ATP) hydrolysereaktion. Der er således blevet gjort mange forsøg på at forklare den molekylære oprindelse af actomyosin -motiliteten.
En myosin power stroke model, foreslået af Huxley og Simmons i 1971, igangsat megen forskning, herunder atomstruktur-undersøgelser og undersøgelse af myosin- og actinmolekylers molekylære biologi. Power stroke -modellen, ændret på det seneste, er bredt vedtaget i standardbøger om biologi.
Imidlertid, der er stadig et alvorligt problem. Ifølge de eksperimentelle termodynamiske data, ATP -hydrolysen i myosinhovedet producerer ikke en myosintilstand med høj nok energi til at generere kontraktionskraften.
Nu, en forskergruppe, ledet af emeritus professor Makoto Suzuki ved Tohoku University i samarbejde med professor Nobuyuki Matubayasi ved Osaka University, er det lykkedes at forklare actomyosin -drivmekanismen i henhold til de eksperimentelle termodynamiske data.
I undersøgelsen, vandstrukturen i nærheden af et aktinfilament (F-actin) modificeres ved binding med et myosinhoved, der hydrolyserer ATP til F-actin, der fører til en ændring i affiniteten til myosinhovedet og dermed til genereringen af aktomyosins drivkraft.
Tilstedeværelsen af den nye intermolekylære overfladekraft - som blev demonstreret for første gang baseret på de nuværende hydratiseringsanalyser - var en markant opdagelse. Denne artikel er, derfor, den første til med succes at afsløre actomyosin -drivmekanismen ved at indføre en ny intermolekylær overfladekraft.
Sidste artikelMonsterfisk i dybden
Næste artikelVildrøvet vender tilbage
 Varme artikler
Varme artikler
-
 Hvordan er celler, væv og organer relateret?En af kompleksiteterne i livet som en multicellulær organisme er, at billionerne af stykker og stykker, der udgør din krop, på en eller anden måde alle må arbejde sammen for at udføre de grundlæggende
Hvordan er celler, væv og organer relateret?En af kompleksiteterne i livet som en multicellulær organisme er, at billionerne af stykker og stykker, der udgør din krop, på en eller anden måde alle må arbejde sammen for at udføre de grundlæggende -
 10 mærkeligste kilder til antibiotikaKilder til antibiotika kan findes nogle meget mærkelige steder. Billedkilde/Photodisc/Getty Images Mange af de lægemidler, som vi er afhængige af i dag, blev opdaget på nogle tydeligt uforskammede st
10 mærkeligste kilder til antibiotikaKilder til antibiotika kan findes nogle meget mærkelige steder. Billedkilde/Photodisc/Getty Images Mange af de lægemidler, som vi er afhængige af i dag, blev opdaget på nogle tydeligt uforskammede st -
 Biologers nye bog beskriver en ny æra i undersøgelsen af evolutionHarvardbiolog Jonathan Losos, på billedet, der håndterer en amerikansk krokodilleskalle på MCZ, fortæller om sin nye bog, “Usandsynlige skæbner:Skæbne, Chance, og evolutionens fremtid. ” Kredit:Kris S
Biologers nye bog beskriver en ny æra i undersøgelsen af evolutionHarvardbiolog Jonathan Losos, på billedet, der håndterer en amerikansk krokodilleskalle på MCZ, fortæller om sin nye bog, “Usandsynlige skæbner:Skæbne, Chance, og evolutionens fremtid. ” Kredit:Kris S -
 Nye slangearter gemmer sig i almindeligt synSara Ruane i New Jersey Pine Barrens med Pine Snake. Kredit:Sara Ruane Samuel McDowell, afdøde herpetolog og professor ved Rutgers-Newark, brugte en god del af sit liv på at studere jordslanger i
Nye slangearter gemmer sig i almindeligt synSara Ruane i New Jersey Pine Barrens med Pine Snake. Kredit:Sara Ruane Samuel McDowell, afdøde herpetolog og professor ved Rutgers-Newark, brugte en god del af sit liv på at studere jordslanger i
- Kina siger, at kulforbruget falder for tredje år
- Forskere skaber MR-lignende teknik til billeddannelse af magnetiske bølger
- Den britiske vagthund bøder børnepasningsfirma for at sælge data
- Klimaændringer får små fuglepar til at dele flere forældreopgaver
- Asteroidebyge på Jord-Måne-systemet for 800 millioner år siden afsløret af månekratere
- Texas Geografi & Jordtyper


